
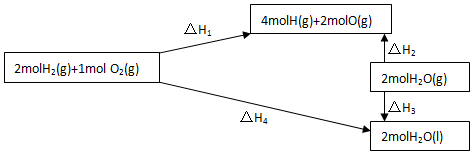
科目:高中化学 来源: 题型:解答题
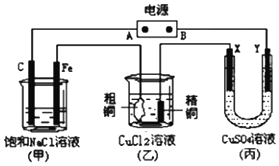 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验要求 | 选项的标号 |
| (1)证明粗盐中含有少量CaCl2 | |
| (2)鉴别Na2SO4溶液和NaCl溶液 | |
| (3)检验氯化亚铁是否变质 | |
| (4)证明某地雨水溶液呈酸性 | |
| (5)除去FeCl2溶液中的少量FeCl3 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
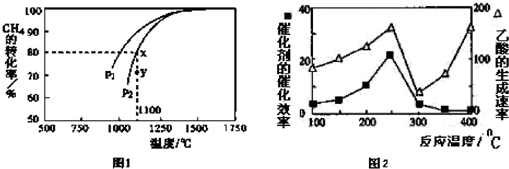
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
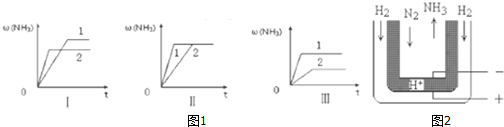
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com