
【题目】关于容量瓶的使用,下列操作不正确的是( )
A.容量瓶是不能作为反应容器或长期贮存溶液的容器
B.用蒸馏水洗涤后不需要将容量瓶烘干
C.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行
D.为了使所配溶液浓度均匀,定容结束后,要摇匀
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素,A元素气态氢化物的水溶液呈碱性,B为最活泼的非金属元素,C元素原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)A元素气态氢化物的电子式为______;B在元素周期表中的位置为________。
(2)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂。该物质的摩尔质量为146 g·mol-1,则该物质的化学式为_____。已知DBn在温度高于45℃时为气态,DBn属于____晶体。该物质被称为人造惰性气体,目前广泛应用于电器工业,在空气中不能燃烧,请从氧化还原角度分析不能燃烧的理由_________。
(3)C与氢元素组成1∶1的化合物,与水发生剧烈反应生成碱和一种气体,写出该反应的化学反应方程式____________,生成1mol气体转移的电子的数目为______个。
(4)A和C两元素可形成离子化合物甲。取13.0g化合物甲,加热使其完全分解,生成A的单质和C的单质,生成的A单质气体折合成标准状况下的体积为6.72L。化合物甲分解的化学方程式为______________________________。
(5)D元素的+4价含氧酸钠盐在空气中容易变质,设计实验方案证明该盐已经变质____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作B是______________(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是_________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上制取金属镁时是电解熔MgCl2,电解反应方程式为_________________。
(4)上图中虚线框内流程的主要作用是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 3.0L0.1mol·L-1NaOH溶液中缓慢通入CO2至溶液增重8.8g时。溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
B. 常温下,将CH3COONa溶液和盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-)
C. 常温下,pH=6的NaHSO3溶液中:c(SO32-)- c(H2SO3)=9.9×10-7mol·L-1
D. Ksp (Fe(OH)3)=1.0×10-38,Ksp (Mg(OH)2)=1.0×10-11,则浓度均为0.1 mol·L-1氯化铁、氯化镁混合溶液,若除去溶液中的Fe3+,应将pH调至3~11。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是
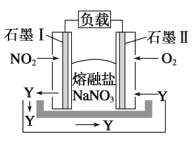
A. 石墨I极为正极,石墨II极为负极
B. Y的化学式可能为NO
C. 石墨I极的电极反应式为NO2+NO3--e-=N2O5
D. 石墨II极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3﹣、MnO4﹣
B.K+、Na+、Cl﹣、SO42﹣
C.K+、Na+、Br﹣、Cu2+
D.Na+、Ba2+、OH﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在日常生活及有机合成中用途广泛。某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O △H=- Q1kJ·mol-1
C2H2(g)+O2(g)=2CO2(g)+H2O(l) △H=- Q2kJ·mol-1
H2(g)+ ![]() O2=(g)=H2O(l) △H=- Q3kJ·mol-1
O2=(g)=H2O(l) △H=- Q3kJ·mol-1
则甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H=____________kJ·mol-1
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
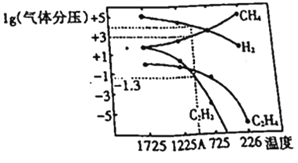
①T1℃时,向2L恒容密闭容器中充入0.3molCH4,发生反应2CH4(g) ![]() C2H6(g)+2H2 (g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为_________________。
C2H6(g)+2H2 (g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为_________________。
②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4平均反应速率r(C2H4) =__________,上述变化过程中T1______T2(填“>”或“<”),判断理由是_________________。
③对于容器中发生的2CH4(g)![]() C2H2(g)+3H2(g),列式计算该反应在图中A点温度时的平衡常数K_____(用平衡分压代替平衡浓度);(已知1g0.05=-1.3)。若只改变一个反应条件使该反应的平衡常数的K值变大。则该条件是:_________(填序号)
C2H2(g)+3H2(g),列式计算该反应在图中A点温度时的平衡常数K_____(用平衡分压代替平衡浓度);(已知1g0.05=-1.3)。若只改变一个反应条件使该反应的平衡常数的K值变大。则该条件是:_________(填序号)
A.可能减小了C2H2的浓度 B.一定是升高了温度
C.可能增大了反应体系的压强 D.可能使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2 与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0kJmol-1
2NO2(g) ΔH=-113.0kJmol-1
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJmol-1
2SO3(g) ΔH=-196.6kJmol-1
则NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=______________________。
SO3(g)+NO(g) ΔH=______________________。
(2)实验中,尾气可以用碱溶液吸收。NaOH 溶液吸收NO2时,发生的反应为:2NO2+2OH-=NO2-+NO3-+H2O,反应中的还原剂是__________;用NaOH 溶液吸收少量SO2的离子方程式为______________________________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2)∶n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示:
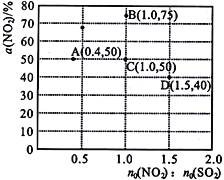
①当容器内_____(填标号)不再随时间的变化而改变时,可以判断反应达到了化学平衡状态。
a.气体的压强 b.气体的平均摩尔质量
c.气体的密度 d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是______________。
③若A 点对应实验中,SO2(g)的起始浓度为c0 molL-1,经过t min达到平衡状态,该时段化学反应速率v(NO2)=______________mol·L-1·min-1。
④图中C、D 两点对应的实验温度分别为Tc和Td,通过计算判断:Tc____Td(填 “>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com