
 、
、 、
、 .
. 分析 活泼金属和活泼非金属之间易形成离子键,非金属之间易形成共价键(铵盐除外);含有离子键的化合物属于离子化合物;
硫化钠中存在钠离子和硫离子,钠离子直接用离子符号表示,硫离子需要标出最外层电子及所带电荷;
氮气中存在3对共用电子对,氮原子最外层达到8个电子;NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对.
解答 解:(1)非金属之间易形成共价键(铵盐除外),则只含有共价键的是HCl、N2、NH3;
故答案为:AFG;
(2)活泼金属和活泼非金属之间易形成离子键,非金属之间易形成共价键(铵盐除外),所以既含共价键又含离子键的是Na2SO4,
故答案为:C;
(3)含有离子键的化合物属于离子化合物,则属于离子化合物的是NaCl、Na2SO4、Na2S;
故答案为:BCD;
(4)Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ;
;
氮气中存在氮氮三键,氮气的电子式为 ;
;
NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ;
;
故答案为: 、
、 、
、 .
.
点评 本题考查了离子键、共价键的判断,难度不大,注意离子键和共价键的区别,离子化合物电子式的书写中相同离子不能合并.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为保护地下钢管不受腐蚀,可使它与锌板或直流电源正极相连 | |
| B. | 在盛水的铁器中,空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆或油脂 | |
| D. | 纯银器表面在空气中因化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
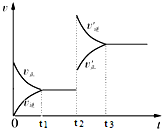 向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )| A. | 重新达到平衡后,平衡常数K增大 | B. | t2时刻改变的条件可以是升高温度 | ||
| C. | I2(g)转化率增大,HI平衡浓度增大 | D. | t2时刻改变是可以增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电池中电子由正极流出,经外电路流向负极 | |
| B. | 燃料电池两极板均发生氧化还原反应 | |
| C. | 燃料电池工作时,通常是将空气通向正极 | |
| D. | 化学电池的放电过程就是电能转化为化学能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
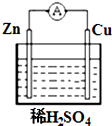 如图所示,在铜锌原电池中,以稀硫酸为电解质溶液:
如图所示,在铜锌原电池中,以稀硫酸为电解质溶液:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com