
ЁОЬтФПЁПвЛжжОпгаИпФмСПБШЕФаТаЭИЩЕчГиЪОвтЭМШчЭМЫљЪОЃЌЪЏФЋЕчМЋЧјЗЂЩњЕФЕчМЋЗДгІЮЊMnO2+eЃ+H2O=MnO(OH)+OH-ЁЃИУзАжУЙЄзїЪБЃЌЯТСаа№Ъіе§ШЗЕФЪЧ

A. AlЕчМЋЧјЕФЕчМЋЗДгІЪНЃКA1-3e-+3NH3ЁЄH2O=Al(OH)3+3NH4+
B. ЪЏФЋЕчМЋЩЯЕФЕчЪЦБШAlЕчМЋЩЯЕФЕЭ
C. УПЯћКФ27gAlЃЌга3molЕчзгЭЈЙ§ШмвКзЊвЦЕНЪЏФЋЕчМЋЩЯ
D. ШєВЩгУЪГбЮЫЎ+NaOHШмвКзїЕчНтжЪШмвКЃЌЕчМЋЗДгІЪНЯрЭЌ
ЁОД№АИЁПA
ЁОНтЮіЁП
ЗХЕчЪБЕФЕчМЋЗДгІЪНжЎвЛЮЊMnO2+e-+H2O=MnO(OH)+OH-ЃЌMnO2ЕУЕчзгЃЌЫљвдЪЏФЋЕчМЋЮЊе§МЋЃЌAlЕчМЋЮЊИКМЋЃЌЪЇЕчзгЃЌдкАБЫЎШмвКжаAlЪЇЕчзгЩњГЩAl(OH)3ГСЕэЃЌдЕчГижабєРызгЯђе§МЋвЦЖЏЃЌЕчзгДгИКМЋСїЯђе§МЋЃЌЕЋЪЧЕчзгВЛФмЭЈЙ§ШмвКЃЌНсКЯЕчМЋЗНГЬЪНМАAl(OH)ЕФСНадХаЖЯЕчМЋЗДгІЕФЧјБ№ЁЃ
A.MnO2дкЪЏФЋЕчМЋЩЯЕУЕчзгЮЊе§МЋЃЌAlЕчМЋЮЊИКМЋЃЌЪЇЕчзгЃЌЗЂЩњбѕЛЏЗДгІЃЌдкАБЫЎШмвКжаAlЪЇЕчзгЩњГЩAl(OH)3ГСЕэЃЌдђИКМЋЕчМЋЗНГЬЪНЮЊA1-3e-+3NH3ЁЄH2O=Al(OH)3+3NH4+ЃЌAе§ШЗЃЛ
B.ЪЏФЋЕчМЋЮЊе§МЋЃЌAlЕчМЋЮЊИКМЋЃЌе§МЋЩЯЕФЕчЪЦБШAlЕчМЋЩЯЕФИпЃЌBДэЮѓЃЛ
C.ЕчзгжЛФмЭЈЙ§ЕМЯпгЩAlЕчМЋзЊвЦЕНЪЏФЋЕчМЋЩЯЃЌCДэЮѓЃЛ
D.ШєВЩгУЪГбЮЫЎ+NaOHШмвКзїЕчНтжЪШмвКЃЌгЩгкAl(OH)3ЪЧСНадЮяжЪЃЌПЩвдБЛNaOHШмвКШмНтЃЌЫљвдЕчМЋЗДгІЪНВЛЯрЭЌЃЌDДэЮѓЃЛ
ЙЪКЯРэбЁЯюЪЧAЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУЙЄвЕСЖЧІВњЩњЕФаПЛв(жївЊГЩЗжЮЊZnOЁЂPbOЁЂFeOЁЂMnO2ЁЂCuO)ПЩЛиЪежЦБИZnCl2ЃЌЙЄвеСїГЬШчЯТЃК

ЛиД№ЯТСаЮЪЬт
(1)ЁАНўШЁЁБЪЕбщжаЃЌЗДгІЬхЯЕЕФЮТЖШЁЂЗДгІЪБМфЖдУЬЭбГ§аЇЙћЕФгАЯьШчЯТБэЃЌдђЪЪКЯЕФЮТЖШКЭЗДгІЪБМфЗжБ№ЪЧ________ЁЂ________ЁЃ
Бэ1ЁЁЮТЖШЖдУЬЭбГ§аЇЙћЕФгАЯь
ЮТЖШ/Ёц | Іб(Mn2+)/mg/L | Г§УЬТЪ/% |
10 | 0.325 | 87.9 |
30 | 0.341 | 89.5 |
50 | 0.424 | 84.3 |
70 | 0.646 | 76.1 |
Бэ2ЁЁЗДгІЪБМфЖдУЬЭбГ§аЇЙћЕФгАЯь
ЪБМф/h | Іб(Mn2+)/mg/L | Г§УЬТЪ/% |
1.0 | 0.995 | 63.1 |
1.5 | 0.794 | 70.6 |
2.0 | 0.328 | 87.9 |
2.5 | 0.325 | 87.9 |
(2)ЁАТЫдќ1ЁБЕФжївЊГЩЗжЪЧ________ЁЃ
(3)H2O2ШмвКЕФзїгУЪЧ___________ЃЌвбжЊЁАТЫдќ2ЁБЕФжївЊГЩЗжЪЧFe(OH)3ЃЌдђбѕЛЏаПЕФзїгУЪЧ____________ЁЃЁАжУЛЛЁБЪЕбщжаЗЂЩњЗДгІЕФРызгЗНГЬЪНгаZn+Pb2+=Pb+Zn2+ЁЂ_________ЁЃ
(4)гЩаПЛвжЦШЁН№ЪєаППЩВЩгУМюШмНтЃЌШЛКѓЕчНтНўШЁвКЃЌвбжЊЃКZnOШмгкNaOHШмвКжаЩњГЩ[Zn(OH)4]2ЃЌдђвѕМЋЕФЕчМЋЗДгІЮЊ____________________________________________ЁЃ
(5)ZnCl2ОЇЬхШмНтгкБЅКЭNa2CO3ШмвКжаЃЌЕУЕН6.46 gЕФМюЪНЬМЫсаП[Znx(CO3)y(OH)z]ЃЌЮЊСЫВтЖЈЦфзщГЩЃЌГфЗжМгШШЗжНтЃЌВњЩњЕФЦјЬхвРДЮЭЈШыХЈСђЫсКЭМюЪЏЛвЃЌжЪСПЗжБ№діжиСЫ0.72gКЭ0.88gЃЌдђИУМюЪНЬМЫсаПЕФЛЏбЇЪНЮЊ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)ЫГВЌ(ЛЏбЇУћГЦЮЊЫГЖўТШЖўАБКЯВЌ(II)ЃЌЛЏбЇЪНЮЊPtCl2(NH3)2ЃЌЯрЖдЗжзгжЪСПЮЊЃК300)ЪЧвЛжжгУгкжЮСЦАЉжЂЕФвЉЮяЃЌвЛЦЌЫГВЌвЉЦЌЫљКЌЫГВЌЕФжЪСПЮЊ6ЁС10-4gЁЃФЧУДвЛЦЌЫГВЌвЉЦЌжаNдзгЕФЮяжЪЕФСП________ЃЛ
(2)ввЯЉЦјЬхЃЈC2H4ЃЉЪЧЪЏгЭЛЏЙЄВњЦЗжЎвЛЃЌвВЪЧзюживЊЕФгаЛњЛЏЙЄЛљДЁдСЯжЎвЛЃЌдкБъзМзДПіЯТЦфУмЖШЮЊ_______g.L-1ЃЛ(вбжЊЃКБъзМзДПіЯТЃЌVm=22.4Lmol-1 )
(3)ЯжгавЛжжПѓШЊЫЎбљЦЗЃЌ1.0Щ§ЕФИУПѓШЊЫЎКЌга4.8ЁС10-2gMg2+ЁЃдђ________Щ§ПѓШЊЫЎжаКЌга1molMg2+ЃЛ
(4)ФГЁА84ЯћЖОвКЁБ1000mLЃЎЦфгааЇГЩЗжЮЊNaClO(ЪНСПЃК74.5)ЃЌжЪСПЗжЪ§ЮЊ14.9ЃЅЃЌУмЖШЮЊ1.2g/LЁЃЦфШмжЪЕФЮяжЪЕФСПХЈЖШЮЊ________ЃЛ
(5)вбжЊCOКЭCO2ЕФЛьКЯЦјЬх7.2gЁЃдкБъзМзДПіЯТЫљеМЕФЬхЛ§ЮЊ4.48LЁЃдђИУЛьКЯЦјЬхжабѕдЊЫиЕФжЪСПЮЊ_______ЃЛ
(6)ШчЭМЫљЪОСНЦПЬхЛ§ЯрЕШЕФЦјЬхЃЌдкЭЌЮТЭЌбЙЯТЃЌШєЦП1СНжжЦјЬх______ЃЈЬюЁАЮяжЪЕФСПЁБЛђепЁАжЪСПЁБЃЉЯрЕШЃЌдђСНЦПжаЕФЦјЬхдзгзмЪ§КЭжЪСПОљЯрЕШЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕЊЛЏТС(AlN)ЪЧвЛжжаТаЭЗЧН№ЪєВФСЯЃЌЪвЮТЯТФмЛКТ§ЫЎНтЁЃПЩгЩТСЗлдкЕЊЦјЗеЮЇжа1700ЁцКЯГЩЃЌВњЮяЮЊАзЩЋЕНЛвРЖЩЋЗлФЉЁЃФГаЁзщЬНОПдкЪЕбщЪвжЦБИAlNВЂВтЖЈВњЦЗДПЖШЃЌЩшМЦЪЕбщШчЯТЁЃЧыЛиД№ЃК
(вЛ)жЦБИAlN

(1)АДЦјСїгЩзѓЯђгвЕФЗНЯђЃЌЩЯЪізАжУЕФе§ШЗСЌНгЫГађЮЊjЁњ__________________Ёњi(ЬювЧЦїНгПкзжФИБрКХ)ЁЃ
(2)ЪЕбщЪБЃЌвдПеЦјЮЊдСЯжЦБИAlNЁЃзАжУAжаЛЙдЬњЗлЕФзїгУЮЊ________________ЃЌзАжУBжаЪдМСXЮЊ_____________________ЁЃ
(Жў)ВтЖЈВњЦЗДПЖШ
ШЁm gЕФВњЦЗЃЌгУвдЯТзАжУВтЖЈВњЦЗжаAlNЕФДПЖШ(МаГжзАжУвбТдШЅ)ЁЃ
вбжЊЃКAlN + NaOH + H2O ЃН NaAlO2 + NH3Ёќ
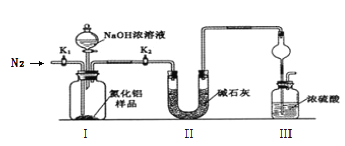
(3)ЭъГЩвдЯТЪЕбщВНжшЃКзщзАКУЪЕбщзАжУЃЌЪзЯШ_________________________________ЃЌМгШыЪЕбщвЉЦЗЁЃНгЯТРДЕФЪЕбщВйзїЪЧЙиБе______________________________ВЂДђПЊ______________ЃЌдйДђПЊЗжвКТЉЖЗЛюШћМгШызуСПNaOHХЈШмвККѓЙиБеЃЌжСВЛдйВњЩњЦјЬхЁЃдй______________ЃЌЭЈШыЕЊЦјвЛЖЮЪБМфЃЌВтЖЈзАжУIIIЗДгІЧАКѓЕФжЪСПБфЛЏЮЊn gЁЃ
(4)ЪЕбщНсЪјКѓЃЌМЦЫуВњЦЗжаAlNЕФДПЖШЮЊ___________Љ(гУКЌmЁЂnЕФДњЪ§ЪНБэЪО)ЁЃ
(5)ЩЯЪіЪЕбщЕФЩшМЦШдШЛДцдкШБЯнЃЌФуШЯЮЊПЩФмЕФШБЯнМАЛсЕМжТЕФВтЖЈНсЙћ____________(гУ ЁАЦЋИпЁБЁЂЁАЦЋЕЭЁБУшЪі)ШчКЮ______________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПБэУїЃЌДѓЦјжаЕЊбѕЛЏЮяКЭЬМЧтЛЏКЯЮяЪмзЯЭтЯпзїгУПЩВњЩњЖўДЮЮлШОЮяЁЊЁЊЙтЛЏбЇбЬЮэЃЌЦфжаФГаЉЗДгІЙ§ГЬШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. ећИіЙ§ГЬжаO3зїДпЛЏМС
B. ЗДгІIIIЕФЗНГЬЪНЮЊO2+O===O3
C. ЙтЛЏбЇбЬЮэжаКЌМзШЉЁЂввШЉЕШДЬМЄадЮяжЪ
D. ЗДгІIЁЂЗДгІЂђОљЪєгкбѕЛЏЛЙдЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЗДгІЂйЃКCO(g)ЃЋCuO(s) CO2(g)ЃЋCu(s)ЗДгІЂкЃКH2(g)ЃЋCuO(s) Cu(s)ЃЋH2O(g)ЃЌЖўепдкЮТЖШTЯТЕФЦНКтГЃЪ§ЗжБ№ЮЊK1КЭK2ЃЌИУЮТЖШЯТЗДгІЂлЃКCO(g)ЃЋH2O(g)CO2(g)ЃЋH2(g)ЕФЦНКтГЃЪ§ЮЊKЁЃдђЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЗДгІЂйЕФЦНКтГЃЪ§K1ЃНc(CO2).c(Cu)/[c(CO).c(CuO)]
B. ЗДгІЂлЕФЦНКтГЃЪ§KЃНK1K2ЁЃ
C. ЖдгкЗДгІЂлЃЌКуШнЪБЃЌЮТЖШЩ§ИпЃЌKжЕМѕаЁЃЌдђе§ЗДгІЁїHЃМ0
D. ЖдгкЗДгІЂлЃЌКуЮТКуШнЯТЃЌдіДѓбЙЧПЃЌH2ХЈЖШвЛЖЈМѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПюб(T)вђОпгагВЖШДѓЁЂШлЕуИпЁЂФЭЫсИЏЪДЕШгХЕуЖјБЛгІгУгкКНПеЁЂЕчзгЕШСьгђЃЌгЩюбЬњПѓ(жївЊГЩЗжЪЧюбЫсбЧЬњFeTiO3)ЬсШЁН№ЪєюбВЂЛёЕУИБВњЦЗFeSO4ЁЄ7H2OЕФЙЄвеСїГЬШчЯТЃК

(1)юбЬњПѓКЭХЈСђЫсЗДгІЕФВњЮяжЎвЛЪЧ TiOSO4ЁЃГЃЮТЯТЃЌИУЮяжЪвзШмгкЫсадШмвКЃЌдкpH=5.0ЪБПЊЪМзЊЛЏЮЊюбЫсГСЕэЃЌдђЮяжЪAЪЧ___________(ЬюЛЏбЇЪНЃЌЯТЭЌ)ЃЌBЪЧ___________ЃЛВНжшЂєЩњГЩTiO(OH)2(H2TiO3)ЕФРызгЗНГЬЪНЪЧ______________________ЁЃ
(2)вбжЊFeSO4ЁЄ7H2OКЭTiOSO4ЕФШмНтЖШЧњЯпШчЭМЫљЪОЃЌдђВНжшЂѓВЩгУЕФВйзїЪЧ___________ЁЃ

(3)ЙЄвЕЩЯПЩЭЈЙ§ЯТСаЗДгІгЩTiO2жЦБИН№ЪєTiЃК
TiO2+2C+2Cl2![]() TiCi4+2CO
TiCi4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
вбжЊЃКГЃЮТЯТTiCl4ЪЧвЛжжМЋвзЫЎНтЕФЮоЩЋвКЬхЃЌЗаЕуЮЊ136.4ЁцЁЃ
ЂйДгЯТСаЙЉбЁгУЕФзАжУжабЁдёКЯЪЪЕФзАжУжЦБИTiCl4ЃЌАДЦјСїЗНЯђСЌНгЦ№РДЃКAЁњ___________Ёњ___________Ёњ___________Ёњ___________ЁњCЁњ___________ЁЃ

ЂкЯТСавЧЦїжаЪЂЗХЕФвЉЦЗЗжБ№ЪЧB___________ЃЌG___________ЁЃ
(4)вЛЖЈЬѕМўЯТЃЌНЋTiO2ШмНтВЂЛЙдЮЊTi3+ЃЌдйвдKSCNШмвКзїжИЪОМСЃЌгУNH4Fe(SO4)2БъзМШмвКЕЮЖЈTi3+жСШЋВПЩњГЩTi4+ЁЃГЦШЁTiO2бљЦЗ0.60gЃЌЯћКФ0.20mol/LЕФNH4Fe(SO4)2ШмвК36.75mLЃЌдђбљЦЗжаTiO2ЕФжЪСПЗжЪ§ЪЧ___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЕчРыЦНКтГЃЪ§H2SO3ЃКH2SO3HSO3- + H+ K1=1.54ЁС10-2 ЃЌHSO3SO32- + H+ K2=1.02ЁС10-7ЃЛ H2CO3ЃКH2CO3HCO3- + H+ K1=4.4ЁС10-7HCO3-CO32- + H+ K2=4.7ЁС10-11ЃЌдђШмвКжаВЛПЩвдДѓСПЙВДцЕФРызгзщЪЧ
A. HSO3-ЁЂCO32- B. HSO3-ЁЂHCO3-
C. SO32-ЁЂHCO3- D. SO32-ЁЂCO32-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбаОПадбЇЯАаЁзщгћВтЖЈЪвЮТЯТЃЈ25ЁцЁЂ101kPaЃЉЕФЦјЬхФІЖћЬхЛ§ЃЌЧыЛиД№ЯТСаЮЪЬтЁЃИУаЁзщЩшМЦЕФМђЕЅЪЕбщзАжУШчЭМЫљЪОЃК

ИУЪЕбщЕФжївЊВйзїВНжшШчЯТЃК
ЂйХфжЦ100mL1.0molLЉ1ЕФбЮЫсШмвКЃЛ
ЂкгУ_______ЃЈЬювЧЦїУћГЦВЂзЂУїЙцИёЃЉСПШЁ10.0mL1.0molLЉ1ЕФбЮЫсШмвКМгШызЖаЮЦПжаЃЛ
ЂлГЦШЁagвбГ§ШЅБэУцбѕЛЏФЄЕФУОЬѕЃЌВЂЯЕгкЭЫПФЉЖЫЃЌЮЊЪЙHClШЋВПВЮМгЗДгІЃЌaЕФЪ§жЕжСЩйЮЊ______ЃЛ
ЂмЭљЙуПкЦПжазАШызуСПЫЎЃЌАДШчЭМСЌНгКУзАжУЃЌМьВщзАжУЕФЦјУмадЃЛ
ЂнЗДгІНсЪјКѓД§ЬхЯЕЮТЖШЛжИДЕНЪвЮТЃЌЖСГіСПЭВжаЫЎЕФЬхЛ§ЮЊVmLЁЃ
ЧыНЋЩЯЪіВНжшВЙГфЭъећВЂЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉгУЮФзжБэЪіЪЕбщВНжшЂмжаМьВщзАжУЦјУмадЕФЗНЗЈЃК______ЁЃ
ЃЈ2ЃЉЪЕбщВНжшЂнжагІбЁгУ______ЃЈЬюађКХЃЉЕФСПЭВЁЃ
AЃЎ100mL BЃЎ200mL CЃЎ500mL
ЖСЪ§ЪБГ§ЛжИДЕНЪвЮТЭтЃЌЛЙвЊзЂвт______ЁЃ
ЃЈ3ЃЉШєКіТдЫЎеєЦјЕФгАЯьЃЌдкЪЕбщЬѕМўЯТВтЕУЦјЬхФІЖћЬхЛ§ЕФМЦЫуЪНЮЊVm=______ЃЌШєЮДГ§ШЅУОЬѕБэУцЕФбѕЛЏФЄЃЌдђВтСПНсЙћ______ЃЈЬюЁАЦЋДѓЁБЁЂЁАЦЋаЁЁБЛђЁАЮогАЯьЁБЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com