
 |
试回答下列问题:
(1) 在未加入H2O2的溶液A中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,你所选择的最合适的试剂是 ▲ (填代号)。
A.KMnO4 B.Fe粉 C. Na2CO3 D.KSCN
向溶液A中加入H2O2,H2O2在该反应中作氧化剂。实验室选用H2O2而不用Cl2作氧化剂除考虑环保因素外的另一原因是 ▲ 。
(2)实验过程中需要进行多次过滤操作,除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是 ▲ 。
 |
科目:高中化学 来源: 题型:
(14 分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:

已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.7 | 6.7 |
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲ (填化学式)。写出该反应的化学方程式 ▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲ (填名称);滴定达到终点的现象为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市海安县高二上学期期末考试化学试卷(带解析) 题型:实验题
(14分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下: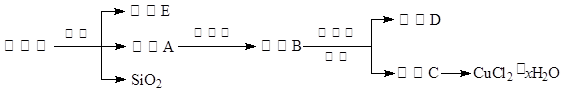
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH: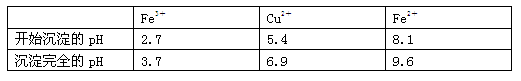
⑴酸溶时,为了提高浸取率可采取的措施有 。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式: 。
⑶加入试剂②的目的是调节pH至a,a的范围是 ;
为避免引入杂质离子,试剂②可选用 。
| A.氨水 | B.氧化铜 | C.氢氧化铜 | D.氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省南通市海安县高二上学期期末考试化学试卷(解析版) 题型:实验题
(14分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
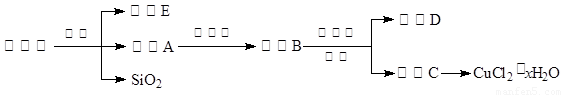
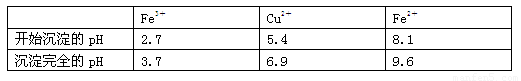
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
⑴酸溶时,为了提高浸取率可采取的措施有 。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式: 。
⑶加入试剂②的目的是调节pH至a,a的范围是 ;
为避免引入杂质离子,试剂②可选用 。
A.氨水 B.氧化铜 C.氢氧化铜 D.氢氧化钠
⑷由溶液C获得CuCl2·xH2O,实验操作依次是加热浓缩、冷却结晶、过滤和洗涤等操作。加热浓缩过程需加入少量盐酸的目的是: 。
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,沉降后废水中Cu2+浓度为 mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:江苏省南通市通州区2010届高三查漏补缺专项练习化学试题 题型:填空题
(14 分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:

已知:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
2.7 |
3.7 |
|
Fe2+ |
7.6 |
9.6 |
|
Cu2+ |
4.7 |
6.7 |
请回答下列问题:
(1)溶液A中含有Cu2+、Fe2+、Fe3+。根据上述实验过程,可作为试剂①的最合理的是 ▲ (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)向溶液B中加入CuO的作用是 ▲ 。
(3)由溶液C获得CuSO4·5H2O,需要经过 ▲ 操作。
(4)制备纳米材料G时,应向CaCl2溶液中先通入 ▲ (填化学式)。写出该反应的化学方程式 ▲ 。
(5)欲测定溶液A中Fe2+的浓度,可取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,滴定时盛放待测液A的玻璃仪器是 ▲ (填名称);滴定达到终点的现象为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com