
下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Fe原子的外围电子排布图为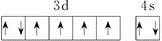
C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
科目:高中化学 来源:2015-2016学年河北省高一下学期期末化学试卷(解析版) 题型:选择题
将铁片和碳棒按图示方式插入硫酸铜溶液中,电流计指针发生偏转。下列针对该装置的说法,正确的是( )
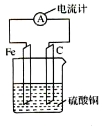
A.碳棒是负极
B.该装置能将电能转化为化学能
C.外电路中电流由铁片流出经过电流计流向碳棒
D.该装置的总反应为:Fe + Cu2+ = Fe2+ + Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省菏泽市高二联考化学试卷(解析版) 题型:选择题
用丙醛(CH3﹣CH2﹣CHO)制取聚丙烯的过程中发生的反应类型为( )
①取代 ②消去 ③加聚 ④缩聚 ⑤氧化 ⑥还原.
A.⑥②③ B.⑤②③ C.②④⑤ D.①④⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期末化学试卷(解析版) 题型:简答题
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。
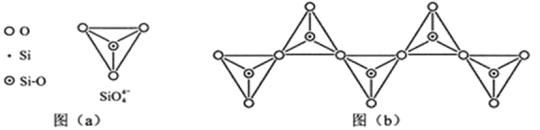
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下学期期末化学试卷(解析版) 题型:选择题
关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是( )
A. 配位体是Cl-和H2O,配位数是9
B. 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C. 内界和外界中的Cl的数目比是1∶2
D. 加入足量AgNO3溶液,所有Cl-均被完全沉淀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市五区县高一下学期期末化学试卷(解析版) 题型:实验题
完成下列问题
Ⅰ.实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)Na2SO3溶液在空气中存放,容易被氧化成 (填化学式)。
检验是否存在该杂质的方法是: 。
(2)操作X的名称为 。
(3)通入Cl2发生反应的离子方程式 。
(4)含碘废液中加入稍过量的Na2SO3溶液,Na2SO3将废液中的I2还原为I-,这样做的目的是 。
Ⅱ.亚硫酸钠溶液中加入过量的碘酸钾酸性溶液,反应的化学方程式为(未配平):
Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O。回答下列问题:
(1)若反应中有5 mole- 转移,则生成碘是 mol。
(2)该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+SO32-→IO―+SO42-(快)
③IO―+SO32-→I―+SO42-(快)
④5I―+6H++IO3-→3I2+3H2O(快)
⑤I2+SO32-+H2O→2I-+SO42-+2H2(快)
由上述条件推测,此反应的总的反应速率由第 步反应决定(填序号)。
(3)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,蓝色现象才会产生。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市五区县高一下学期期末化学试卷(解析版) 题型:选择题
下列实验误差分析错误的是
A. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B. 容量瓶中含有少量蒸馏水对所配制的溶液无影响
C. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
D. 测定中和反应的中和热时,保温效果越好,测定误差越小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高二下学期期末化学试卷(解析版) 题型:实验题
实验室模拟合成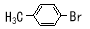 和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
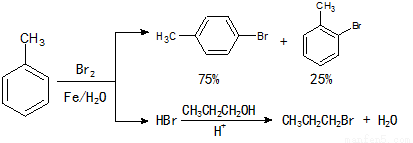
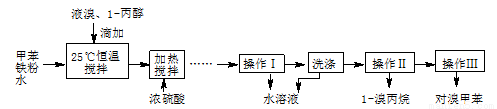
实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如下:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入 ,以减少溴的挥发。写出甲苯和液溴反应生成对溴甲苯的化学方程式 。
(2)反应装置如图所示:
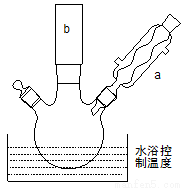
①图中玻璃仪器a的名称是 , 方块b中为某玻璃仪器,
其名称是 。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和 。加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是 。
(3)操作I的名称是 ,操作Ⅲ的名称是 。
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00 mL,用0.1000 mol·L-1 NaOH溶液滴定,以测定溶液pH。该同学认为无需加入指示剂,也能完成滴定。他提出这一观点的理由是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下学期期末化学试卷(解析版) 题型:选择题
下列实验不能达到预期目的的是()
序号 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属强弱 |
B | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | 测定相同浓度H2CO3、H2SO4两溶液的pH | 比较碳、硫的非金属强弱 |
D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com