
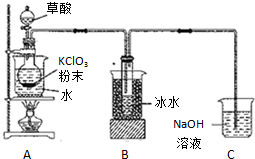
 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用KClO3粉末与草酸(H2C2O4)在60℃时反应可生成ClO2等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用KClO3粉末与草酸(H2C2O4)在60℃时反应可生成ClO2等物质,实验装置如图所示:分析 (1)二氧化氯(ClO2)沸点为11℃,用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,装置A必须添加温度控制装置;ClO2的沸点低,用冰水可以使ClO2冷凝为液体;
(2)KClO3和草酸发生氧化还原反应生成ClO2、K2CO3、CO2和H2O;
(3)①根据ClO2在碱溶液中发生岐化其氧化产物和还原产物的物质的量比为1:1,可知Cl的化合物由+4变为+3和+5,还原产物为NaClO2,氧化产物为NaClO3;
②NaClO2溶液中制得NaClO2晶体的操作步骤:蒸发结晶、趁热过滤;
(4)H2O2作还原剂时氧化产物为O2,不会产生环境污染.
解答 解:(1)二氧化氯(ClO2)沸点为11℃,用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,装置A必须添加温度控制装置,故装置A中还应安装的玻璃仪器是温度计;装置B用冰水浴的原因是ClO2的沸点:11.0℃,沸点低,用冰水可以使ClO2冷凝为液体,收集在试管中或常温下二氧化氯为气态
故答案为:温度计;常温下二氧化氯为气态;
(2)KClO3和草酸发生氧化还原反应生成ClO2、K2CO3、CO2和H2O,反应的化学方程式为2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O,
故答案为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;
(3)①根据ClO2在碱溶液中发生岐化其氧化产物和还原产物的物质的量比为1:1,可知Cl的化合物由+4变为+3和+5,还原产物为NaClO2,氧化产物为NaClO3,
因此化学方程式为:2ClO2+2OH-=ClO2-+ClO3-+H2O,
故答案为:2ClO2+2OH-=ClO2-+ClO3-+H2O;
②NaClO2溶液中制得NaClO2晶体的操作步骤:蒸发结晶、趁热过滤、洗涤、干燥,
故答案为:蒸发结晶; 趁热过滤;
(4)还可采用盐酸或双氧水还原氯酸钠制备ClO2.用H2O2作还原剂制备ClO2更受欢迎,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2,不会产生环境污染,
故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(A-)<c(K+) | B. | c(H+)=c(OH-)<c(K+)<c(A-) | ||
| C. | V总≥20mL | D. | V总≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)<S(1)<S(s) | B. | S(g)>S(1)>S(s) | C. | S(g)>S(1)=S(s) | D. | S(g)>S(s)>S(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 1.0 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com