
| A. | 1 mol Al与含1mol H2SO4的稀硫酸溶液反应 | |
| B. | 1mol Cu与含4mol HNO3的浓硝酸溶液反应 | |
| C. | 1 mol Cu与含2 mol H2SO4的浓硫酸共热 | |
| D. | 1 mol MnO2与足量浓盐酸共热 |
分析 先根据两种反应物的物质的量判断哪种过量,按照量少的计算,参加反应的物质的量,然后根据化合价的变化计算转移电子的物质的量.
解答 解:A.根据反应2Al+3H2SO4═Al2(SO4)3+3H2↑可知,1mol铝完全反应消耗1.5mol硫酸,硫酸只有1mol,所以反应生成氢气的物质的量按照硫酸的计算,1mol硫酸完全反应生成1mol氢气,转移了2mol电子,故A不选;
B.根据铜与浓硝酸反应方程式Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O可知,4mol硝酸完全反应需要消耗1mol铜,当硝酸变为稀硝酸时发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,4mol硝酸完全反应需要消耗1.5mol铜,而铜只有1mol,所以铜不足,转移的电子按照铜的物质的量计算,1mol铜完全反应生成铜离子转移了2mol电子,故B不选;
C.铜与浓硫酸的反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,1mol铜完全反应需要消耗2mol硫酸,同时生成1mol二氧化硫气体,由于随着反应的进行,浓硫酸浓度减小,当浓硫酸变成稀硫酸,铜不与稀硫酸反应,所以常见反应的铜的物质的量小于1mol,转移的电子小于2mol,故C选;
D.1 mol MnO2与足量浓盐酸共热,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,MnO2全部反应,转移电子为2mol,故D不选.
故选C.
点评 本题考查了氧化还原反应中电子转移的计算,题目难度中等,注意掌握计算氧化还原反应中电子转移数目的方法,明确判断反应物过量的方法.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s、p、d、f各能级的轨道数目分别为1、3、5、7 | |
| B. | 各电子层的能级都是从s能级开始至 f 能级结束 | |
| C. | 各电子层含有的能级数为(n-1) | |
| D. | 各电子层含有的电子数为2n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子最外层电子的个数 | |
| B. | 1 mol金属与酸反应放出氢气的多少 | |
| C. | 1 mol金属失去电子的多少 | |
| D. | 金属原子失去电子的难易程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 B>A>C>D | B. | 最高价氧化物水化物的碱性B>A | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 氢化物的稳定性 C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数多 | |
| C. | 2.6g26Al3+中所含的电子数约为6.02×1023 | |
| D. | 26Al3+和26Mg2+的质子数、中子数和电子数均不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某澄清透明溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 含0.1mol•L-1 Ba2+的溶液中:Na+、K+、SO42-、Cl- | |
| C. | 含0.1mol•L-1 CO32-的溶液中:OH-、Cl-、NH4+、Na+ | |
| D. | 加入铝粉产生H2的溶液中:Al3+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的摩尔质量为16g | |
| B. | 标准状况下,18 g H2O的体积是22.4 L | |
| C. | 17 g NH3的物质的量是1 mol | |
| D. | 阿伏加德罗常数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
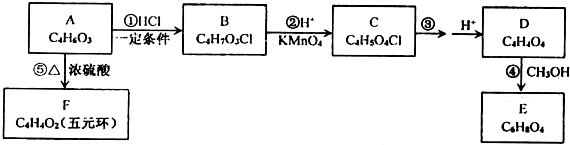
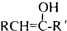 (R和 R′,代表烷基或 H)不稳定,本题各物质均不考虑此类结构.
(R和 R′,代表烷基或 H)不稳定,本题各物质均不考虑此类结构. 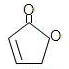 E(反式):
E(反式):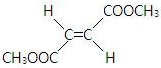
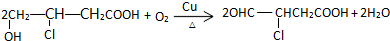 .
.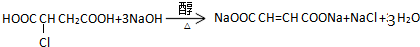 .
. .
.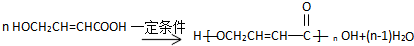 .
.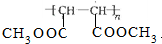 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com