
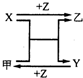
 回答下列问题:
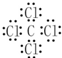
回答下列问题: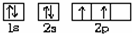 ,乙的电子式为
,乙的电子式为 .
. ,乙的化学式为NaCl.
,乙的化学式为NaCl.分析 由图可知,甲+X=Y+乙是置换反应,X+Z=乙,Y+Z=甲都是化合反应,则
(1)X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子,则X为Mg,甲为CO2,Y为C,乙为MgO;
(2)X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂,则X为Na,甲为CCl4,乙为NaCl;
(3)X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X为Al,甲为Fe3O4,Y为Fe,以此来解答.
解答 解:由图可知,甲+X=Y+乙是置换反应,X+Z=乙,Y+Z=甲都是化合反应,则
(1)X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子,则X为Mg,甲为CO2,Y为C,乙为MgO,Y原子的基态轨道表示式为 MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为
MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为 ,
,
故答案为: ;
; ;
;
(2)X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂,则X为Na,甲为CCl4,为共价化合物,则甲的电子式为 ,乙为NaCl,
,乙为NaCl,
故答案为: ;NaCl;
;NaCl;
(3)X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X为Al,甲为Fe3O4,Y为Fe,X与甲反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,Y的原子序数为26,其原子基态电子排布式为[Ar]3d64s2,故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;[Ar]3d64s2.
点评 本题考查无机物的推断,为高频考点,把握置换反应的特点及物质的性质、电子排布推断物质为解答的关键,侧重分析与综合应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2、NaClO中所含化学键类型完全相同 | |
| B. | 只有活泼金属与活泼非金属元素之间才能形成离子键 | |
| C. | D2O和T2O是同一物质 | |
| D. | 氯气与NaOH反应的过程中,同时又离子键、极性键和非极性键的断裂和形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
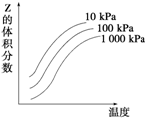 下图是温度和压强对可逆反应 X+Y?2Z 反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
下图是温度和压强对可逆反应 X+Y?2Z 反应影响的示意图.图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | X和Y状态无法确定,Z为气态 | D. | 上述反应的逆反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能为甲烷和乙烷的混合物 | B. | 一定有乙烯 | ||
| C. | 混合物中可能含有丙烷 | D. | 两种气态烃一定都有四个H原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
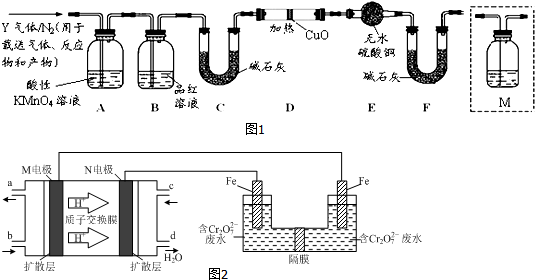
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )
2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )| A. | CO与CO2均为酸性氧化物 | |
| B. | 大量CO2的排放可导致酸雨的形成 | |
| C. | CO与O形成化学键过程中有电子转移 | |
| D. | 相同条件下,CO的密度比CO2的密度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,不是 SO2的漂白性 | |
| C. | 通入SO2时,SO2与I2反应,I2作氧化剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式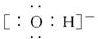 | B. | CH4分子的球棍模型 | ||
| C. | 乙烯的最简式(实验式) CH2 | D. | 苯乙醛结构简式 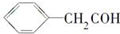 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com