
 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)根据电子流向可知c为负极,负极发生氧化反应,溶液中阳离子移向正极,甲醇被氧化生成二氧化碳和水;
(3)根据反应热等于反应物的总键能-生成物的总键能求算;
(4)利用盖斯定律计算反应热,并书写热化学方程式.
解答 解:(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,则热化学方程式为:2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)原电池中电子从负极经外电路流向正极,根据电子流向可知c电极为负极,甲醇在负极上发生氧化反应,氢离子移向正极右侧,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:a;右;CH3OH-6e-+H2O=CO2+6H+;
(3)N2(g)+3H2(g)???2NH3(g)△H=945kJ•mol-1+436kJ•mol-1×3-akJ•mol-1×6=-93kJ•mol-1,a=391 kJ•mol-1,故答案为:391;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJ•mol-1
利用盖斯定律将①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+$\frac{1}{2}$×(-571.6kJ/mol)-$\frac{1}{2}$×(-2599 kJ/mol)=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查了热化学方程式的书写、原电池原理以及电极反应式的书写、据键能计算焓变、盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气溶于水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH${\;}_{4}^{+}$+OH-═NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
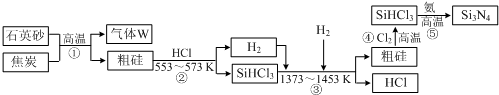
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
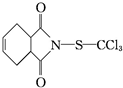 )是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )
)是一种广谱性的主要用于叶面保护的杀菌剂,无药害,在果树、蔬菜及各种经济作物上使用.下列说法正确的是( )| A. | 克菌丹的分子式为C9H8O2NSCl3,属于芳香族化合物 | |
| B. | 克菌丹易溶于水,在加热条件下不能与NaOH溶液反应 | |
| C. | 克菌丹能与溴的CCl4溶液发生取代反应使之褪色 | |
| D. | 克菌丹在一定条件下能发生取代、加聚等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质子数与中子数相等的氢原子符号${:}_{1}^{1}$H | |
| B. | 乙烯的比例模型: | |
| C. | 双氧水的电子式:${H}_{•}^{•}{\stackrel{••}{\underset{••}{O}}}_{•}^{•}{\stackrel{••}{\underset{••}{O}}}_{•}^{•}$H | |
| D. | 次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 该反应每消耗3 molX,转移电子的物质的量为2mol | |
| D. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
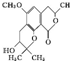
| A. | 每个分子中有2个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1 mol该物质最多可与含2 mol NaOH的水溶液反应 | |
| D. | 分子中有3种含氧官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com