
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
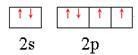 (2分)(2)
(2分)(2)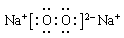 (2分)
(2分) (1分)
(1分)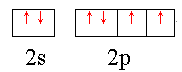
 (2)化合物Q2W2是过氧化钠,含有离子键和非极性键,电子式为
(2)化合物Q2W2是过氧化钠,含有离子键和非极性键,电子式为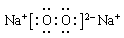 。化合物XYZ是HCN,分子中含有三键,所以结构式为H-C N.。
。化合物XYZ是HCN,分子中含有三键,所以结构式为H-C N.。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.元素的非金属性:X<Y<Z |
| B.气态氢化物的稳定性按X、 Y、 Z顺序增强 |
| C.X、Y、 Z的最高价氧化物水化物的酸性由强到弱 |
| D.X、 Y、 Z原子的最外层电子数依次增多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一周期中,碱金属元素的第一电离能最大 |
| B.同周期元素中,ⅦA族元素的原子半径最大 |
| C.当各轨道处于全满、半满、全空时原子较稳定 |
| D.ⅥA族元素的原子,其半径越大,越容易得到电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素非金属性由强到弱的顺序是: Z> Y>X |
| B.Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 |
| C.3种元素的气态氢化物中,Z的气态氢化物最稳定 |
| D.原子半径由大到小的顺序为 Z >Y>X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性:Al(OH)3、Mg(OH)2、NaOH |
| B.还原性:HI、HBr、HCl |
| C.酸性:HClO4、H2SO4、H3PO4 |
| D.稳定性:H2CO3、NaHCO3、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HXO4 | B.H2YO4 | C.H3ZO4 | D.H4WO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
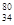 Se。下列有关该同位素的说法正确的是( )
Se。下列有关该同位素的说法正确的是( )| A.质子数为80 | B.电子数为114 | C.中子数为46 | D.质量数为34 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | | +2 | +1 | +5 | +7 | +1 | +5 |
| 最低负化合价 | -2 | | | -3 | -1 | | -3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com