
为测定镁铝合金(不含其它元素)中铝的质量分数,甲、乙、丙三个学习小组设计了下列三种不同的实验方案进行探究.请回答下列问题:
(一)甲组:实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托盘天平称量一定质量镁铝合金粉末
②溶解:将①中药品加入烧杯中,加入过量的 NaOH 溶液,不断搅拌,充分反应.发生反应的离子方程式为: ↑
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将 (填“偏高”、“偏低”或“不变”)
⑤干燥、称量剩余固体
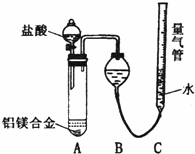
(二)乙组:实验方案:镁铝合金 测定生成气体的体积,实验装置如图所示.
测定生成气体的体积,实验装置如图所示.
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置.你的意见是
(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(要求写出二点): 、
(三)丙组:实验方案:12g镁铝合金 溶液
溶液
操作1包括过滤、洗涤、干燥和称量,并最终得到固体物质1.45g.则该合金中铝的质量分数为 95% .
考点:
探究物质的组成或测量物质的含量;镁的化学性质;铝的化学性质.
专题:
实验探究和数据处理题.
分析:
(一)②金属铝可以和氢氧化钠之间发生反应,但是金属镁和氢氧化钠之间不会发生反应;
④固体表面沾有偏铝酸钠溶液,称量剩余固体质量会偏大;
(二)(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;
(2)装置的气密性、合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
(三)根据得到的沉淀是氢氧化镁,结合镁元素守恒得到金属镁的质量,进而计算该合金中铝的质量分数.
解答:
解:(一)②金属铝可以和氢氧化钠之间发生反应2Al+2OH﹣+6H2O=2[Al(OH)4]﹣+3H2↑,故答案为:2Al+2OH﹣+6H2O=2[Al(OH)4]﹣+3H2↑;
④固体表面沾有偏铝酸钠溶液,称量剩余固体质量会偏大,测定铝的质量分数减小,测定质量分数偏低,故答案为:偏低;
(二)(1)由于氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置,故答案为:不需要;
(2)反应中装置的气密性、合金是否完全溶解都会影响测定结果,所以需要检查装置的气密性;合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等)
故答案为:检查装置的气密性;合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案);
(三)金属镁、铝和盐酸反应得到氯化镁和氯化铝的混合液,再加入足量的氢氧化钠,过滤得到的固体物质1.45g是氢氧化镁的质量,物质的量是 =0.025mol,所以金属镁的质量是0.025mol×24g/mol=0.6g,所以金属铝的质量分数=
=0.025mol,所以金属镁的质量是0.025mol×24g/mol=0.6g,所以金属铝的质量分数= ×100%=95%,故答案为:95%.
×100%=95%,故答案为:95%.
点评:
本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
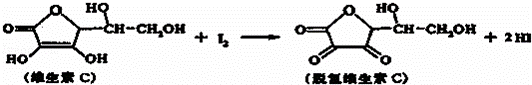
下列说法正确的是( )
|
| A. | 维生素C的分子式为C6H8O6 |
|
| B. | 维生素C在酸性条件下水解得到3种产物 |
|
| C. | 维生素C不溶于水,可溶于有机溶剂 |
|
| D. | 上述反应为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素及其化合物性质的比较正确的是( )
|
| A. | 原子半径:F<O<Al | B. | 稳定性:H2O<PH3<NH3 |
|
| C. | 酸性:H2CO3<H2SO4<H3PO4 | D. | 碱性:LiOH<NaOH<Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
阴离子Xn﹣含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明碳的非金属性强于硅的是
| A.2C+SiO2 | B.稳定性:CH4>SiH4 |
| C.CaCO3+SiO2 | D.金刚石不导电,晶体硅能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。根据要求回答下列问题:
(1)基态Ni的价电子构型(电子排布式)为______________________。
(2)Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂,则Ni(CO)4属于_______晶体。
(3)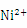 可与丁二酮肟(
可与丁二酮肟(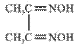 )作用生成腥红色配合物沉淀A。
)作用生成腥红色配合物沉淀A。
①丁二酮肟分子中碳原子的杂化轨道类型有______________,1mol该分子中含有的碳碳σ键和碳氮σ键的总数为__________。
②氨气在水中的溶解度远大于甲烷,其原因是____________。
③腥红色配合物沉淀A中(结构如下)除含有一般共价键外,还含有配位键和氢键,请在下图中标出配位键和氢键。
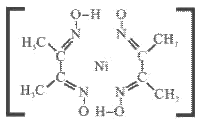
(提示: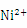 的配位数为4,配位键用“→”表示,氢键用“…”表示)
的配位数为4,配位键用“→”表示,氢键用“…”表示)
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,该新型超导晶体的一个晶胞的结构如下图所示,则该晶体的化学式为__________。
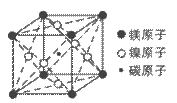
查看答案和解析>>
科目:高中化学 来源: 题型:
)下列溶液中微粒的物质的量浓度关系正确的是( )
|
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO﹣)>c(OH﹣)>c(H+) |
|
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X﹣)>c(OH﹣)=c(H+) |
|
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(NH4+)>c(Cl﹣)>c(NH3•H2O)>c(OH﹣)>c(H+) |
|
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(S2﹣)+2c(OH﹣)=2c(H+)+c(HS﹣)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A. 质量相等,密度不等的N2和C2H4两种气体含有的分子数一定相等
B. 同温同压下,等体积的H2和He气含有的质子数相等
C. 某物质经分析仅含一种元素,此物质可能是纯净物也可能是混合物
D. FeCl3溶液呈电中性,Fe(OH)3胶体带有电荷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com