
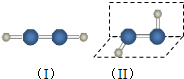
 过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:分析 (1)由极性键构成的分子,若结构不对称,正负电荷中心不重叠则为极性分子;极性分子细液流在电场中会发生偏转;
(2)根据题目信息,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明另一种产物为沉淀;
(3)BaO2与硫酸反应生成硫酸钡、氧气和水;
(4)双氧水具有强氧化性用酸式滴定管量取,配制250mL溶液需要250mL容量瓶;
(5)酸性高锰酸钾溶液为紫色,达到滴定终点时溶液呈浅紫红色且半分钟内不褪色;根据反应方程式计算25mL溶液中双氧水的物质的量,然后求出其质量,再求出1L溶液中的双氧水的质量.
解答 解:(1)H2O2分子中含有氧氢极性共价键和氧氧非极性共价键,由极性键构成的分子,若结构不对称,正负电荷中心不重叠则为极性分子;极性分子细液流在电场中会发生偏转;
a.分子的熔沸点与分子间作用力有关,与分子是否对称无关,故a错误;
b.过氧化氢分解时吸收的能量与氢氧键的键能有关,与分子是否对称无关,故b错误;
c.图示两种结构,过氧化氢分子中的氢氧键与氧氧键键长均相同,无法鉴别,故c错误;
d.图示两种结构,猜想1为对称结构的非极性分子,猜想2为非对称结构的极性分子,极性分子细液流在电场中发生偏转,非极性分子细液流在电场中不发生偏转,观察过氧化氢细液流在电场中是否发生偏转,可确定猜测中有一种正确,故d正确;
故答案为:极性;d;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明另一种产物为沉淀,则生成了硫酸钡沉淀,所以选用BaO2;反应生成过氧化氢和硫酸钡沉淀,过滤即可得到纯净的过氧化氢;
故答案为:BaO2;过滤;
(3)若反应时没有用冰冷却,会有气体产生,则生成的氧气,即BaO2与硫酸反应生成硫酸钡、氧气和水,其反应的化学方程式为:2BaO2+2H2SO4=2BaSO4+O2↑+2H2O;
故答案为:2BaO2+2H2SO4=2BaSO4+O2↑+2H2O;
(4)双氧水具有强氧化性用酸式滴定管量取,配制250mL溶液需要250mL容量瓶,所以取5.00mL 双氧水样品,配制成250mL溶液,实验过程必须用到的两种主要仪器为酸式滴定管、250 mL容量瓶;
故答案为:酸式滴定管、250 mL容量瓶;
(5)酸性高锰酸钾溶液为紫色,达到滴定终点时双氧水完全反应,溶液变为浅紫红色且半分钟内不褪色;
反应离子方程式是:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,
n(MnO4-)=cV=0.020mol/L×0.0155L=3.10×10-4mol,
n(H2O2)=$\frac{5}{2}$n(MnO4-)=$\frac{5}{2}$×3.10×10-4mol
则25.00mL上述溶液中双氧水的质量:m(H2O2)=nM=$\frac{5}{2}$×3.10×10-4mol×34g/mol=2.635×10-2g,
所以1000mL即1L双氧水样品溶液中双氧水的质量:m(H2O2)=2.635×10-2g×$\frac{1000mL}{5mL}$=52.7g,则则原双氧水样品中含过氧化氢52.7g/L,
故答案为:溶液呈浅紫红色且半分钟内不褪色;52.7.
点评 本题考查了制备实验方案设计,考查制备原理、分子结构、氧化还原反应的产物判断及方程式的书写、物质含量的计算等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C10H14的一元取代芳烃,其可能的结构有5种 | |
| B. | 分子式为C2H4O的只能表示一种物质 | |
| C. | 甲酸甲酯能发生银镜反应,并与丙酸互为同系物 | |
| D. | 丙烯在一定条件下与水反应主要产物是2-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2CO3<HSO4<HClO4 | D. | 熔点:Na>K>Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于浓HNO3和浓H2SO4氧化性均较强,常温下都不可用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| B. | 大豆富含蛋白质,故豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 石油的分馏、煤的气化、海水提溴的过程都包含化学变化 | |
| D. | 地淘油经处理后可作为汽车燃油,故地沟油的成分是液态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com