
 .②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.
.②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.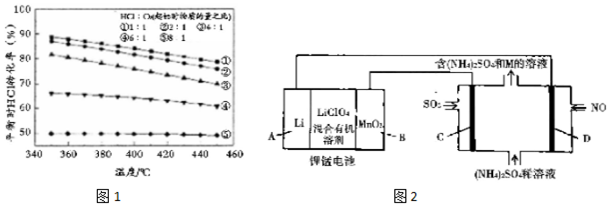
分析 (1)①氨分子中氢原子被氨基(-NH2)取代后的生成物叫肼,分子中全部为单键;
②肼的水溶液呈弱碱性,在水溶液中溶质为N2H4•2H2O,第一步电离相当于N2H4夺取水的质子,产生OH-,显碱性;
(2)NH3 与CO2合成尿素和液态水的化学方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l),该反应可由已知热效应的化学方程式推导,根据盖斯定律计算该反应的热化学方程式;
(3)①根据化学平衡常数表达式,代入各组分的平衡浓度计算;
②增加HCl的用量,HCl 平衡转化率随温度的降低变化不大,根据图1分析变化不大的原因;
③为了制备含氧量低的氯气,除了提高 HCl 和 O2投料比,还可以通过化学平衡正向移动达到目的,从温度和压强角度分析;
(4)①根据电极反应式分析溶液中的产物,据此判断物质M的组分;
②NO转化为(NH4)2SO4,这个过程中N化合价降低,发生还原反应,据此写出D电极的电极反应式.
解答 解:(1)①氨分子中氢原子被氨基(-NH2)取代后的生成物叫肼,分子中全部为单键,电子式为 ,故答案为:
,故答案为: ;
;
②肼的水溶液呈弱碱性,在水溶液中溶质为N2H4•2H2O,第一步电离相当于N2H4夺取水的质子,产生OH-,显碱性,则N2H4•2H2O在水中第一步电离的电离方程式为:N2H4•2H2O?[N2H5•H2O]++OH-,
故答案为:N2H4•2H2O?[N2H5•H2O]++OH-;
(2)已知:①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H1=-159.5kJ/mol,
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H2=+116.5kJ/mol,
③H2O(l)═H2O( g)△H3=+44.0kJ•mo1,
NH3 与CO2合成尿素和液态水的化学方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l),该反应可由①+②-③得到,根据盖斯定律,该反应的焓变△H=△H1+△H2-△H3=-159.5+116.5-44.0=-87.0kJ/mol,
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0kJ/mol;
(3)①$\frac{n(HCl)}{n({O}_{2})}$=4:1,温度为 360℃时 HCl 的平衡转化率为80%,且c(HCl)=0.4mol/L,则HCl的起始浓度为$\frac{0.4mol/L}{1-80%}$=2mol/L,则起始时O2的浓度为0.5mol/L,根据反应方程式,平衡时c(HCl)=0.4mol/L,c(O2)=0.1mol/L,c(Cl2)=c(H2O)=0.8mol/L,则该温度下,化学平衡常数为K=$\frac{{c}^{2}({H}_{2}O){c}^{2}(C{l}_{2})}{c({O}_{2}){c}^{4}(HCl)}$=$\frac{(0.8mol/L)^{2}×(0.8mol/L)^{2}}{0.1mol/L×(0.4mol/L)^{4}}$=160L/mol,
故答案为:160L/mol;
②增加HCl的用量,HCl 平衡转化率随温度的降低变化不大,从图1分析,350℃时HCl的转化率接近50%,此时将投料比变成HCl:O2=8:l,O2的转化率已经接近100%,可见降低温度并不能使HCl的平衡转化率改变多少,
故答案为:350℃时HCl的转化率接近50%,根据投料比HCl:O2=8:l,此时O2的转化率已经接近100%,因此再降低温度,HC1的转化率也不会增大很多;
(4)①电化学装置可将雾霾中的SO2、NO转化为(NH4)2SO4,锂锰电池中电解质是LiClO4,Li+通过电解质迁移入MnO2 晶格中,生成 LiMnO2,则MnO2电极处得到电子,做原电池正极,与之相连的电解池中的石墨电极就为阳极,阴极上SO2反应,失去电子,该电极的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,所以还生成M为H2SO4,
故答案为:H2SO4;
②NO转化为(NH4)2SO4,这个过程中N化合价降低,发生还原反应,则D电极反应式为NO+6H++5e-=NH4++H2O,故答案为:NO+6H++5e-=NH4++H2O.
点评 本题考查化学原理知识,属于综合题型,包含电子式的书写,弱电解质的电离平衡,热化学方程式的书写,盖斯定律的应用,化学平衡常数的计算,化学平衡的移动,电化学知识,电极反应式的书写,均为常见题型,也都是高频考点,平时需要加强练习,题目难度中等,试题有助于培养综合运用化学原理的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 原子晶体中共价键越强,熔点越高 | ||
| C. | 晶体中有阳离子必含阴离子 | D. | 分子间作用力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数 | |
| B. | 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol | |
| C. | 100g98%的浓硫酸所含的氧原子个数为4mol | |
| D. | 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①、③互为同分异构体 | B. | ②的分子式为C10H18O | ||
| C. | ①能使酸性高锰酸钾溶液褪色 | D. | ①、②、③都能与金属钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为C25H24 | |
| B. | 最多可能有5个碳原子在同一直线上 | |
| C. | 该分子中最多可能有13个碳原子在同一平面上 | |
| D. | 该有机物能使酸性高锰钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 试剂或操作 | |
| 鉴别乙醇和乙酸 | |
| 鉴别棉花和蚕丝 | |
| 除去乙烷中混有的乙烯 | |
| 除去苯中溶解的溴单质 | |
| 鉴别植物油和矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 在硫酸亚铁溶液中滴加含NaOH的次氯酸钠溶液 | 产生红褐色沉淀 | 硫酸亚铁已变质 |
| B | 在蔗糖的水解液中滴加银氨溶液,加热 | 没有银镜生成 | 蔗糖未水解 |
| C | 向CaCl2溶液中通入纯净的SO2 | 产生白色沉淀 | CaCl2与SO2反应生成CaSO3 |
| D | 在0.1mol/L AlCl3溶液中滴加少量NaOH溶液,再滴加0.1mol/L FeCl3溶液 | 先产生白色沉淀,后白色沉淀转化成红褐色沉淀 | Ksp[Fe(OH)3]< Ksp[Al(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2 与 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| B. | 可逆反应在一定条件下可达到平衡状态,该状态下,正、逆反应速率相等,都为零 | |
| C. | 可逆反应不能进行到底,必然有反应物剩余 | |
| D. | 可逆反应的速率很小,达到最大限度时反应停止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com