
【题目】某无机盐除结晶水外,还含两种阳离子和一种阴离子,摩尔质量为392 g·mol1,为探究其组成和性质,设计并完成了如下实验:
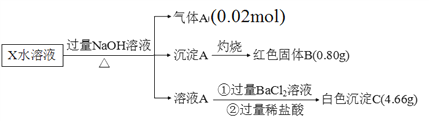
请回答:
(1)X的化学式为_______________。
(2)生成红褐色沉淀A的反应方程式____________________________________________。
(3)检验X溶液中金属阳离子的方法为_______________________________。
【答案】 (NH4)2Fe(SO4)26H2O Fe2+ + 2OH- = Fe(OH)2↓ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 先加KSCN溶液无明显现象,再加氯水,溶液变为红色或 滴加酸性KMnO4溶液,溶液褪色
【解析】X的水溶液中加入过量的NaOH溶液,加热,生成0.02mol气体A,气体A为氨气,说明含有0.02mol NH4+,沉淀A灼烧生成红色固体B,B为氧化铁(Fe2O3),含有铁元素的物质的量为![]() ×2=0.01mol,溶液A中加入氯化钡和稀盐酸,生成白色沉淀C,C为硫酸钡,说明含有SO42-,且物质的量=
×2=0.01mol,溶液A中加入氯化钡和稀盐酸,生成白色沉淀C,C为硫酸钡,说明含有SO42-,且物质的量= ![]() =0.02mol,根据电荷守恒,含有的铁元素为Fe2+,化学式为(NH4)2Fe(SO4)2nH2O,根据摩尔质量为392 g·mol1,n=6。
=0.02mol,根据电荷守恒,含有的铁元素为Fe2+,化学式为(NH4)2Fe(SO4)2nH2O,根据摩尔质量为392 g·mol1,n=6。
(1)根据上述分析,X的化学式为(NH4)2Fe(SO4)26H2O,故答案为:(NH4)2Fe(SO4)26H2O;
(2)亚铁离子首先生成氢氧化亚铁,然后氢氧化亚铁被氧化生成氢氧化铁,反应的方程式为Fe2+ + 2OH- = Fe(OH)2↓、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,故答案为:Fe2+ + 2OH- = Fe(OH)2↓、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;
(3)检验Fe2+的方法为:先加KSCN溶液无明显现象,再加氯水,溶液变为红色(或滴加酸性KMnO4溶液,溶液褪色),故答案为:先加KSCN溶液无明显现象,再加氯水,溶液变为红色(或滴加酸性KMnO4溶液,溶液褪色)。


科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
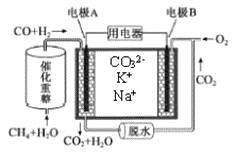
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol e-
3H2+CO,每消耗1molCH4转移12mol e-
B. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
C. 电池工作时,CO32-向电极B移动
D. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Na+、CO32-、HCO3-、SO32-、Cl-,在加入Na2O2后浓度不发生变化的是
A. Na+、CO32- B. Cl- C. CO32-、Cl- D. HCO3-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家模拟足贝类足丝蛋白的功能,合成了一种对云母、玻璃、二氧化硅等材料具有良好粘附性的物质──化合物I,其合成路线如下:

回答下列问题:
(1)A的化学名称为___________________。
(2)由B生成C的化学方程式为_______________________________________________。
(3)由E和F反应生成D的反应类型为________________,由G和H反应生成I的反应类型为________________。
(4)D的结构简式为__________,仅以D为单体合成高分子化合物的化学方程式为___________________________________________________________。
(5)I的分子式为_____________________。
(6)X是I的同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1。写出两种符合要求的X的结构简式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH4+、CO32、Cl、SO32、SO42。某同学为确定其成分,设计并完成以下实验(不考虑水解,所加试剂均足量):
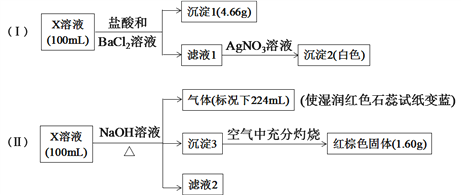
下列说法正确的是
A. X溶液中一定存在Na+、SO32、SO42、CO32
B. X溶液中一定存在NH4+、Na+、SO42,至少含有Fe3+、Fe2+离子中的一种
C. 取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+
D. X溶液中一定含有Cl,且c(Cl)≥0.1mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量分别是n(H)=______mol;n(C)=_______mol
(2)该有机物的分子式_____________,写出所有可能结构简式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( ) 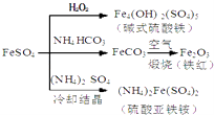
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
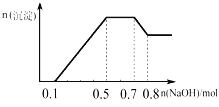
A. 溶液中的阳离子只有H+、Mg2+、Al3+
B. 溶液中一定不含CO32﹣,一定含有SO42﹣和NO3﹣
C. 溶液中n(NH4+)=0.25mol
D. 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=2:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+ 11O2= 4B2O3+ 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
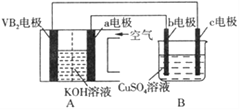
A. VB2电极发生的电极反应为:2VB2+ 11H2O - 22e-= V2O5+ 2B2O3+ 22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,c电极表面先有红色物质析出,b电极有气泡产生
D. 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com