
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
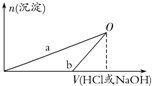 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| A. | b曲线表示的是向X溶液中加入NaOH溶液 | |
| B. | 在O点时两方案中所得溶液浓度相等 | |
| C. | 方案②中对应的O点HCl恰好反应完 | |
| D. | X溶液显酸性,Y溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1>2c2 | B. | c2=2c1 | C. | c2<c1<2c2 | D. | c1=2c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | B极区电解液为LiCl溶液 | |
| B. | 电极每产生22.4L气体,电路中转移2mole- | |
| C. | 电解过程中Li+迁移入B电极区、OH-迁移入A电极区 | |
| D. | 电解池中总反应方程式为:2LiCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com