
| A. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| B. | 袋装食品常用生石灰作为食品的抗氧化剂 | |
| C. | 金属焊接时可用饱和NH4Cl溶液作除锈剂 | |
| D. | 泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
分析 A、石油的分馏是利用物质的沸点不同进行分离;
B、生石灰有吸水性,但无强还原性;
C、饱和NH4Cl溶液水解显酸性;
D、硫酸铝水解使溶液显酸性,故硫酸铝溶液会与铁反应,应放在内筒里.
解答 解:A、石油的分馏是利用物质的沸点不同、利用加热的方法将石油中的各组分进行分离,属于物理变化,故A错误;
B、生石灰有吸水性,但无强还原性,故只能防止食品潮解但不能防止氧化,故B错误;
C、饱和NH4Cl溶液水解显酸性,能除去金属表面的锈,且不至于腐蚀金属,故C正确;
D、硫酸铝水解使溶液显酸性,故硫酸铝溶液会与铁反应,应放在内筒塑料桶里,外筒为铁桶,外筒和内筒之间装有碳酸氢钠溶液,故D错误;
故选C.
点评 本题考查了化学物质在生活中的应用,难度不大,注意基础知识的积累,生活处处皆学问.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:解答题
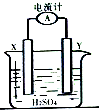 某同学进行如图所示的铜--锌原电池实验,已知电解质溶液中H+向X极移动.
某同学进行如图所示的铜--锌原电池实验,已知电解质溶液中H+向X极移动.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家屠呦呦因发现治疗疟疾的特效药青蒿素而获诺贝尔生理医学奖.青蒿素的结构如图所示,有关青蒿素的说法不正确的是( )
我国科学家屠呦呦因发现治疗疟疾的特效药青蒿素而获诺贝尔生理医学奖.青蒿素的结构如图所示,有关青蒿素的说法不正确的是( )| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素分子内的过氧基团是对付疟原虫的核心基团 | |
| C. | 青蒿素能够发生水解反应 | |
| D. | 青蒿素分子中有6个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{蒸发}{→}$无水MgCl2 | |
| D. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{盐酸}{→}$FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
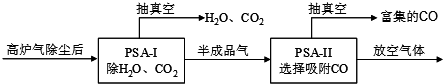
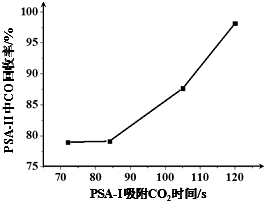
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H10的烷烃的二氯取代物 | |
| B. | 分子式为C4H10O2的有机物 | |
| C. | 乙苯的一氯取代物 | |
| D. | 和H2加成生成2-甲基戊烷的单烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| H2C204 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
| HF | Ka=6.32×10-4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度范围/℃ | 120-220 | 300-350 | 450-500 | 高于600 |
| 固体/g | 22.05 | 11.25 | 11.85 | 13.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 出售给工厂作工业原料 | |
| B. | 就地焚烧成草木灰作植物的钾肥 | |
| C. | 应用化学科学的有关原理和方法制成甲烷作燃料 | |
| D. | 应用化学科学的有关原理和方法制成优质的牲畜饲料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com