
����Ŀ�����������������Ҫ��������������������й㷺Ӧ�á����������ж����������γ��������Ҫ���塣������ʵ�����Ʊ����ǹ�ҵ��������������β�����ջ��������dz���Ҫ�����������գ�
(1)ʵ���ҿ���ͭ��Ũ������Ȼ�������������Ʒ�Ӧ��ȡ��������

A��װ��a Bװ��b

C��װ��c D��װ��d
�����������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ���ͼ�п�ѡ�õķ���װ���� _________(��д��ĸ)��
(2)����������������Ʒ�Ӧ��ȡ3.36 L(��״��)��������������Ҫ��ȡ��������____________________g(����һλС��)���������4.0%��������(��������)�������������ƣ����������ȡ����������________g (����һλС��)��
(3)ʵ���Ҷ�������β�������빤ҵ��������Ļ�ѧԭ����ͨ��ʯ�ң�ʯ�෨�ͼ�dz��õ���������ʯ�ң�ʯ�෨�����շ�ӦΪSO2��Ca(OH)2=CaSO3����H2O�����ղ�����������ɹܵ���������������������ӦΪ2CaSO3��O2��4H2O=2CaSO4��2H2O������������ͼ��

������շ�ӦΪSO2��2NaOH=Na2SO3��H2O������ص����������Ƽ���ǿ�����տ죬Ч�ʸߡ�����������ͼ��
��֪��

ʯ�ң�ʯ�෨�ͼ���ն�������Ļ�ѧԭ����֮ͬ���� _____________________���ͼ��ȣ�ʯ�ң�ʯ�෨���ŵ���__________________��ȱ����__________________��
(4)��ʯ�ң�ʯ�෨�ͼ�Ļ����ϣ����һ���Ľ��ģ���ʵ������ѭ������������(������ͼ��ʾ) _______��
���𰸡� AD 18.9 19.8 ����SO2���������������Ӧ ԭ���ã����ճɱ��� ������������Ч�ʵ� 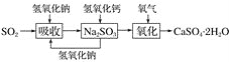
����������1��������������Ʒ�Ӧ�Ļ�ѧ����ʽΪNa2SO3+H2SO4=Na2SO4+H2O+SO2������Ӧ����Ϊ������+Һ���������ϣ���ܿ��Ʒ�Ӧ���ʣ�ʹ�÷�Һ©����
��2�����ݻ�ѧ����ʽNa2SO3+H2SO4=Na2SO4+H2O+SO2����2Na2SO3+O2=2Na2SO4��ʽ���㡣
��3��ʯ��-ʯ�෨�ͼ����SO2�Ļ�ѧԭ����֮ͬ��������SO2���������������Ӧ�����ݱ������ݣ�ʯ��-ʯ�෨���ŵ��ǣ�ԭ���ã����ճɱ��͡�����������Ϣ��ʯ��-ʯ�෨��ȱ������������������Ч�ʵ͡�
��4�����ڼ����SO2�����տ졢Ч�ʸߣ���������NaOH����SO2����NaOH�۸��������SO2�ijɱ��ߣ�����Ҫʵ��NaOH��ѭ�����ã����ʯ��-ʯ�෨���ŵ㣬��Na2SO3�м���Ca��OH��2��ʹNaOH������ͬʱ����CaSO3��CaSO3�����ɵõ�CaSO4��2H2O��
��1��������������Ʒ�Ӧ�Ļ�ѧ����ʽΪNa2SO3+H2SO4=Na2SO4+H2O+SO2������Ӧ����Ϊ������+Һ���������ϣ���ܿ��Ʒ�Ӧ���ʣ�ʹ�÷�Һ©������ѡ��װ��a��װ��d����ѡAD��
��2�����ݷ�ӦNa2SO3+H2SO4=Na2SO4+H2O+SO2����������n��Na2SO3��=n��SO2��=![]() =0.15mol��������Ҫ��ȡ�������Ƶ�����Ϊ0.15mol
=0.15mol��������Ҫ��ȡ�������Ƶ�����Ϊ0.15mol![]() 126g/mol=18.9g���������4.0%���������������������������������ƣ���ԭ���������Ƶ�����Ϊ18.9 g
126g/mol=18.9g���������4.0%���������������������������������ƣ���ԭ���������Ƶ�����Ϊ18.9 g![]() ��1-4.0%��=19.6875 g������2Na2SO3+O2=2Na2SO4��Na2SO3�������ɵ������Ƶ�����Ϊ��19.6875 g��18.9 g��
��1-4.0%��=19.6875 g������2Na2SO3+O2=2Na2SO4��Na2SO3�������ɵ������Ƶ�����Ϊ��19.6875 g��18.9 g��![]() =0.8875 g��������Ҫ��ȡ���ʺ���������Ƶ�����Ϊ18.9 g+0.8875 g
=0.8875 g��������Ҫ��ȡ���ʺ���������Ƶ�����Ϊ18.9 g+0.8875 g![]() 19.8 g��
19.8 g��
��3��ʯ��-ʯ�෨��ԭ���ǣ�SO2+Ca��OH��2=CaSO3��+H2O��2CaSO3+O2+4H2O=2CaSO4��2H2O�������SO2�ķ�Ӧԭ���ǣ�SO2+2NaOH=Na2SO3+H2O��ʯ��-ʯ�෨�ͼ����SO2�Ļ�ѧԭ����֮ͬ��������SO2���������������Ӧ�����ݱ������ݣ�Ca��OH��2�۸�͡�����SO2�ijɱ��ͣ�ʯ��-ʯ�෨���ŵ��ǣ�ԭ���ã����ճɱ��͡�����������Ϣ������ص����������Ƽ���ǿ�����տ죬Ч�ʸ�����ʯ��-ʯ�෨��ȱ������Ca��OH��2�ܽ�ȵͣ���Һ��������������������Ч�ʵ͡�
��4�����ڼ����SO2�����տ졢Ч�ʸߣ���������NaOH����SO2����NaOH�۸��������SO2�ijɱ��ߣ�����Ҫʵ��NaOH��ѭ�����ã����ʯ��-ʯ�෨���ŵ㣬��Na2SO3�м���Ca��OH��2��ʹNaOH������ͬʱ����CaSO3��CaSO3�����ɵõ�CaSO4��2H2O�������̿��Ա�ʾΪ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������Ϊx��Ԫ��E�����ڱ���λ��A��B��C��D����Ԫ���м�(��ͼ��ʾ)����A��B��C��D����Ԫ�ص�ԭ������֮�Ͳ�������(��ϵ���ϵ��0��Ԫ�س���)(����)

A. 4x B. 4x��6 C. 4x��10 D. 4x��14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ĵ���ʽ��______���ṹʽ��________����ռ乹����_______���ڹ��յ������£�������Ժ���������_______��Ӧ�������ڿ�������ȫȼ�յĻ�ѧ����ʽ_________________��
��2����������е��˶�Ա������˻�Ť��ʱ����ҽ��Ѹ�ٶ��˶�Ա�����˲�λ����һ��ҩ������������(�е�Ϊ12.27 ��)���оֲ��䶳����Ӧ���������������������ȡ����Ӧ����������ķ�Ӧ����ʽΪ______________________��
��3�������������䶳����Ӧ��������ԭ����_________��
A�������鲻��ȼ�� B���������ӷ� C���������������л��ܼ� D��������������ˮ
��4����ȡCH3CH2Cl��õķ�����________��
A��������������Ӧ B����ϩ��������ӦC��������HCl��Ӧ D����ϩ��HCl��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N2��H2�������ֱ����ס��ҡ������������н��кϳɰ���Ӧ������һ��ʱ�������ʷ�Ӧ����Ϊ����(H2)��3 mol��L��1��min��1������(N2)��2 mol��L��1��min��1������(NH3)��1 mol��L��1��min��1�������ʱ�������������кϳɰ��ķ�Ӧ����(����)
A. �ף��ң��� B. �ף��ң��� C. �ң��ף��� D. �ף�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء�������������ȷ����
A. ������ע��Һ���ܲ��������ЧӦ�������ڽ���
B. ú�ĸ����ʯ�͵ķ��������ѧ�仯
C. ![]() ��������������ļ�����
��������������ļ�����![]() ��
��![]() ��Ϊͬλ��
��Ϊͬλ��
D. �ý��ݹ����������Һ�Ĺ���������ˮ���ͷŵ���ϩ���ɴﵽˮ�����ʵ�Ŀ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǽס��ҡ�����λͬѧ��ȡ���������Ĺ��̣�������벢Э������������ʵ������
(1)ʵ��Ŀ�ģ���ȡ����������
(2)ʵ��ԭ�����ס��ҡ�����λͬѧ����ȡ�Ҵ���������Ũ�����Ϲ��ȵķ�����ȡ������������Ӧ�ķ���ʽΪ______________������Ũ�����������______________��
(3)װ����ƣ��ס��ҡ�����λͬѧ�ֱ������������ʵ��װ�á�

��Ӽס�����λͬѧ��Ƶ�װ����ѡ��һ����Ϊʵ������ȡ����������װ�ã���ѡ���װ����______________(ѡ��ס����ҡ�)����ͬѧ����װ���еIJ����ܸij����θ���ܣ��������������⣬��һ��Ҫ������___________________________��
(4)ʵ�鲽�裺
�ٰ���ѡ���װ�����������Թ����ȼ���2mLŨ���ᣬ��������3mL�Ҵ����ҡ�ȣ���ȴ���ټ���2mL�����
�ڽ��Թ̶ܹ�������̨�ϣ�
�����Թ�B�м��������ı���̼������Һ��
���þƾ��ƶ��Թ�A���ȣ�
�ݵ��۲쵽�Թ�B������������ʱֹͣʵ�顣
����Ϊʵ������д��ڵĴ�����____________________________________________��
(5)�������ۣ�
���Թ�B�б���̼������Һ��������_________________________________________��
�ڴ��Թ�B�з��������������ʵ�������______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ�������£��������·�Ӧ��NO��g��+CO��g�� ![]() N2��g��+CO2��g����H=��373.2kJ/mol���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ�ǣ�������
N2��g��+CO2��g����H=��373.2kJ/mol���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ�ǣ�������
A.�Ӵ���ͬʱ�����¶�
B.�Ӵ���ͬʱ����ѹǿ
C.�����¶�ͬʱ����N2
D.�����¶�ͬʱ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У�ʼ��������������ǣ� ��
A.SO2ͨ��Ba(NO3)2��Һ��
B.O2ͨ��Na2SO3��Һ��
C.Cl2ͨ��Na2SiO3��Һ��
D.NH3ͨ��Ca(HCO3)2��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�ָ�Ч�Ķ��ˮ������������ǿ�����ԡ��Ʊ�������ط����ܶࡣ
��1���ɷ��Ʊ�������ء���Fe2O3��KNO3��KOH��ϼ��ȹ��������Ϻ�ɫ�������κ�KNO2�Ȳ�����Ʊ���Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ_____________________��
��2��ʪ���Ʊ�������ء���ҵ�ϳ�����NaClO������������ԭ�����£�
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4��+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
��Ҫ������������ͼ��

������ͼ�С�ת��������ij�����½��еģ�˵�����¶��µ��ܽ��S(K2FeO4)_____S(Na2FeO4)���>����<����=������
��ʪ���Ʊ��У���Ӧ���¶ȡ�ԭ�ϵ�Ũ�Ⱥ���ȶԸ�����صIJ��ʶ���Ӱ�졣��ͼ��ͼ��Ϊ��ͬ���¶��£���ͬ����Ũ�ȵ�Fe(NO3)3��K2FeO4�����ʵ�Ӱ�죻ͼ��Ϊһ���¶��£�Fe(NO3)3����Ũ�����ʱ��NaClOŨ�ȶ�K2FeO4�����ʵ�Ӱ�졣��ҵ����������¶�Ϊ_________�棬��ʱFe(NO3)3��NaClO ������Һ�������Ũ��֮��Ϊ______________��

����NaClO������������������л�����Fe(OH)3��д���÷�Ӧ�����ӷ���ʽ��_____________________����Fe( NO3)3����������ڼ��Խ�����K2FeO4��Fe3+����������ԭ��Ӧ����K3FeO4���˷�Ӧ�����ӷ���ʽΪ__________________________________��
��3��K2FeO4��ˮ��Һ����ˮ�⣺4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2����
4Fe(OH)3+8OH-+3O2����
���ڡ��ᴿ��K2FeO4�в����ؽᾧ��ϴ�ӡ����º�ɵķ�������ϴ�Ӽ����ѡ��__________��Һ(�����)��
A.H2O B.CH3COOK������� C.NH4Cl������� D.Fe(NO3)3�������
��K2FeO4�ڴ���ˮ�Ĺ����������������_______________________��
��4�������£�����Fe3+��CuSO4��Һ�м���Cu(OH)2��ʹFe3+ת��ΪFe(O H)3�������Ӷ���ȥFe3+���÷�Ӧ��ƽ�ⳣ��Ϊ_____________________��(��֪�����µ��ܶȻ�������Ksp[Cu(OH)2]=2.0��10-20�� Ksp[Fe(OH)3]=4.0��10-38)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com