
如果国际社会能够就温室效应气体减排达成《后京都议定书》,到2020年发达国家整体上会减排30%。大气中CO2的含量增加会引起“温室效应”,自然界消耗CO2的反应主要是( )
A.CO2+2NaOH===Na2CO3+H2O
B.CaCO3+CO2+H2O===Ca(HCO3)2
C.6CO2+6H2O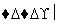 C6H12O6+6O2
C6H12O6+6O2
D.CO2+C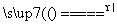 2CO
2CO
科目:高中化学 来源: 题型:
下列解释事实的方程式不正确的是( )
A.测0.1mol/L氨水的pH为11:NH3·H2O NH4++OH-
NH4++OH-
B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH +H2↑
+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 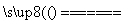 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在 过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
依据下列条件能将某溶液的物质的量浓度计算出来的是( )
①每10 mL溶液中含有0.23 g Na+的硫酸钠溶液
②每10个水分子中溶有1个Na+的NaOH溶液
③浓度为18.4 mol·L-1的硫酸10 mL加到100 mL水中所得的稀硫酸
④标准状况下,100 mL氨气溶于20 mL水中所得溶液的密度为0.9 g·cm-3的氨水
A.①② B.①③
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4 L C8H18中含有的共价键键数为25NA
B.56 g Fe与71 g Cl2充分反应,转移了2NA个e-
C.22.4 L NO与22.4 L O2充分混合后的气体中含有3NA个O原子
D.1 mol/L的MgCl2溶液中含2NA个Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
某固体物质A受热分解,生成B、C、D三种物质。B是一种钾盐,向B的水溶液中加入澄清石灰水,产生白色沉淀E;E溶于盐酸放出无色无味气体D;将D通入澄清石灰水中,先出现浑浊现象,然后又变澄清;C在常温下是一种无色液体。
(1)写出A、B、E的化学式。
A________,B________,E________。
(2)写出反应的化学方程式。
①A受热分解:______________________________________________________;
②将D通入澄清石灰水中,先出现浑浊现象,然后又变澄清:
________________________________________________________________________。
(3)写出反应的离子方程式。
①向B的水溶液中加入澄清石灰水,产生白色沉淀E:
_____________________________________________________________________;
②E溶于盐酸放出无色无味的气体D:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能够证明甲烷分子的空间结构为正四面体的事实是( )
A.甲烷没有同分异构体
B.甲烷的四个碳氢键完全一样
C.甲烷的一氯代物只有一种
D甲烷的二氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+ O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
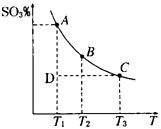
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
②若温度为T1时,反应进行到状态D时,V正_______V逆(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产中有重要作用。
① 右图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:(△H用含字母Q1、Q2的代数式表示) 。
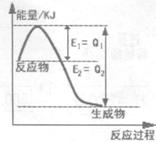
②在AlCl3溶液中滴加氨水,反应的离子方程式为: 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是 全品教学网, 用后离不了!,产生该现象的原因是(用离子方程式表示): 。
全品教学网, 用后离不了!(已知25℃时Ksp[AgCl] =1.0×10-10 mol2•L-2,Ksp[AgI] =1.5×10-16mol2•L-2 )
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在溶液中可以发生反应:X+2Y3+===X2++2Y2+,则下列解释:①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+要强.其中正确的是( )
A.②④⑥ B.①③④
C.①③⑤⑥ D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com