
| A. | 淀粉的最简式:CH2O | B. | 邻羟基苯甲酸的结构简式: | ||
| C. | 2-乙基-1,3-丁二烯的键线式: | D. | 苯分子球棍模型: |
分析 A、最简式指用元素符号表示化合物分子中各元素的原子个数比的最简关系式;
B、 为间羟基苯甲酸,不是邻羟基苯甲酸;
为间羟基苯甲酸,不是邻羟基苯甲酸;
C、首先写出结构式,根据结构式再写出键线式;碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略;
D、球棍模型反应分子中各原子的连接方式.
解答 解:A、淀粉的最简式为C6H10O5,故A错误;
B.邻羟基苯甲酸,俗名水杨酸,其结构简式为 ,故B错误;
,故B错误;
C、2-乙基-1,3-丁二烯的键线式为 ,故C正确;
,故C正确;
D、图为苯分子的比例模型,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,明确常见化学用语的书写原则为解答关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | 盐酸与NaOH溶液反应的中和热△H=-57.3kJ•mol-1,则硫酸和Ca(OH)2溶液反应的中和热△H=-2×57.3kJ•mol-1 | |
| D. | 一定条件下,0.1molN2(g)与0.3molH2(g)混合充分反应时放出的热量为8kJ,则有N2(g)+3H2(g)?2NH3(g)△H=-80kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
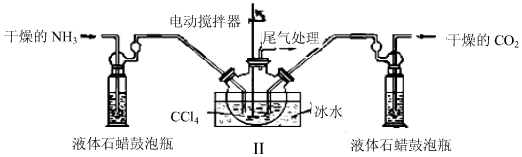
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
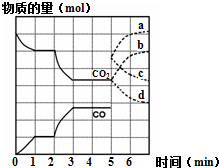 有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.
有效地开发利用碳资源可适当解决能源危机.运用化学反应原理的相关知识研究碳及其化合物的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com