
【题目】学生设计的用氨催化法制取少量HNO3溶液的实验装置如图所示: 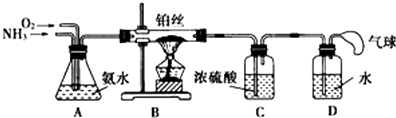
(1)实验室制备NH3 , 下列方法中适宜选用的是(填序号). ①固态氯化铵与熟石灰混合加热 ②固态氯化铵加热分解
③碱石灰中滴加浓氨水 ④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为 .
(3)装置C的作用是;装置C中的现象是;为确保装置D中尽可能多地生成HNO3 , 所通入O2和NH3的体积比应大于 .
(4)装置D中发生的反应化学方程式为 .
【答案】
(1)①③
(2)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(3)吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1
(4)3NO2+H2O═2HNO3+NO
【解析】解:(1)①固态氯化铵与熟石灰混合加热,是实验室制氨气的主要方法,故①正确; ②固态氯化铵加热分解,成氨气和氯化氢,氯化氢和氨气反应生成氯化铵,故②错误;③碱石灰中滴加浓氨水,也是实验室制氨气的方法之一,故③正确;④氯化铵溶液与氢氧化钠溶液共热,氨气易溶于水,能制得氨气但量少,不适合实验室制备氨气,故④错误;故选:①③;(2)氨催化氧化生成一氧化氮和水,方程式为:4NH3+5O2 ![]() 4NO+6H2O;所以答案是:4NH3+5O2
4NO+6H2O;所以答案是:4NH3+5O2 ![]() 4NO+6H2O;(3)装置C浓硫酸的作用是吸收未反应的NH3 , 装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3 , 其含义就是NH3通过转化后全部生成HNO3 , 由4NH3+5O2
4NO+6H2O;(3)装置C浓硫酸的作用是吸收未反应的NH3 , 装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3 , 其含义就是NH3通过转化后全部生成HNO3 , 由4NH3+5O2 ![]() 4NO+6H2O 及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1,所以答案是:吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1;(4)NO2与H2O反应,生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,所以答案是:3NO2+H2O═2HNO3+NO.
4NO+6H2O 及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1,所以答案是:吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1;(4)NO2与H2O反应,生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,所以答案是:3NO2+H2O═2HNO3+NO.


科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式己配平): Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成,则A应该属于______(填序号)
a.电解质 b.非电解质 c.硫化物 d.酸性氧化物 e.碱性氧化物
(2)A物质可以使酸性KMnO4溶液褪色,此反应中______(填写化学式,下同)失去电子,还原产物是______。
(3)一定量的铜片与100mL18mol/L的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为______g,发生还原反应的硫酸的物质的量为___________mol。
(4)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:______、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9.2 g金属钠投入到100 g下列不同质量分数的盐酸中,则放出的氢气( )
①2.00% ②3.65% ③10% ④36.5%
A. ①最少B. ④最多C. ③居中D. 一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分,回答下列问题(用元素符号填写):
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)分别写出①、③两种元素形成的高价态化合物的结构式
(2)写出⑨的原子结构示意图 .
(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式 , 其溶于水时破坏的作用力为
(4)这些元素的最高价氧化物的对应水化物中酸性最强;形成的两性氢氧化物的化学式是;上述两者反应的离子方程式
(5)从⑤到的元素中,原子半径最小 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 主族元素的原子及其离子的核外电子层数等于该元素所在的周期数
B. 稀有气体原子的最外层电子数都是8
C. 元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素
D. 互为同位素的元素物理性质、化学性质均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1,反应的平衡常数K1为_________

(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____________________。
②列式计算温度T时反应的平衡常数K2 =________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于分子间作用力的叙述不正确的是
A. 是一种较弱的化学键
B. 分子间作用力较弱,破坏它所需能量较少
C. 分子间作用力对物质的熔、沸点有影响
D. 稀有气体液化后分子间存在分子间作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com