
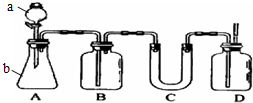
 如图A是实验室用石灰石和稀盐酸制取CO2的常用装置.请选用适当的化学试剂和实验用品,用图中的D装置收集一瓶干燥、纯净的CO2气体.
如图A是实验室用石灰石和稀盐酸制取CO2的常用装置.请选用适当的化学试剂和实验用品,用图中的D装置收集一瓶干燥、纯净的CO2气体.分析 由图可知,a为分液漏斗,b为锥形瓶,在A中发生CaCO3+2HCl=CaCl2+H2O+CO2↑,B中饱和碳酸氢钠溶液除去HCl,C中固体干燥剂吸收水,D为向上排空气法收集二氧化碳气体,以此来解答.
解答 解:(1)由图可知,a为分液漏斗,b为锥形瓶,故答案为:分液漏斗;锥形瓶;
(2)二氧化碳不燃烧不支持燃烧,则检验D中气体是否收集满了的操作是燃着木条靠近集气瓶口,木条熄灭,故答案为:燃着木条靠近集气瓶口;
(3)B中装入一定量的饱和NaHCO3目的除去A挥发的HCl反应的方程式为NaHCO3+HCl=NaCl+H2O+CO2↑,故答案为:NaHCO3+HCl=NaCl+H2O+CO2↑;
(4)浓硫酸为液体,烧碱、碱石灰均与二氧化碳反应,则U型管中干燥剂为无水氯化钙,故答案为:c.
点评 本题考查气体的制备实验,为高频考点,把握反应原理、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意混合物分离提纯,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 安徽合肥大麻饼 | B. | 湖北武汉热干面 | C. | 湖南长沙臭豆腐 | D. | 山西杏花村汾酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛的结构简式是:CH3CHO | |
| B. | 乙烯的球棍模型 | |
| C. | CCl4的电子式为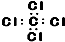 | |
| D. | 含中子数为10的氧元素的一种核素 10O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L乙烯中含有的分子数为NA | |
| B. | 0.1 L 0.1 mol/L的CH3COOH溶液中含有的分子数为0.01 Na | |
| C. | 含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数0.1Na | |
| D. | 1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| B. | 铁溶于盐酸中:Fe+6H+═Fe3++3H2↑ | |
| C. | 氯化铝溶液和氨水反应 Al3++NH3•H2O═Al(OH)3↓+NH4+ | |
| D. | NaHCO3溶液与HCl溶液反应:H++HCO3-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃ | |
| D. | 0.2mol/L Na2S2O3和0.1mol/L H2SO4溶液各5mL,加水10mL,反应温度30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量HSO3-的澄清透明溶液中:K+、OH-、Cl-、Na+ | |
| B. | 能使无色酚酞变红的溶液中:Ca2+、NH4+、Cl-、Fe2+ | |
| C. | 有NO3-存在的强酸性溶液中:Na+、Mg2+、I-、Br- | |
| D. | 能与Fe反应放出大量H2的溶液:Al3+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2 | B. | 0.5 mol NH3 | ||
| C. | 6.02×1023个的CH4分子 | D. | 0.3 mol H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com