
常温下有A和B两种气体的混合物,已知B的相对分子质量大于A的相对分子质量,混合气体中只含碳氢两元素,而且不论它们以何种比例混合,碳氢质量比总是小于9:1.而大于9:2,若混合气体中碳氢质量比是5:1,则A在混合气体中的体积分数为:
A.88.89% B.80% C.20% D.11.11%
科目:高中化学 来源: 题型:阅读理解




查看答案和解析>>
科目:高中化学 来源: 题型:


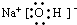
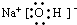
 H++HO2ˉ
H++HO2ˉ H++HO2ˉ
H++HO2ˉ| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①A的化学式是 ;
②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是 ;
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省菏泽市高三第二次模拟考试化学试卷(解析版) 题型:推断题
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是 (填具体离子符号);由A、B、C三种元素按 4:2:3组成的化合物所含的化学键类型属于 。
(2)用某种废弃的金属易拉罐与 A、C、D组成的化合物溶液反应,该反应的离子方程式为: 。
(3)A、C两元素的单质与熔融K2CO3,组成的燃料电池,其负极反应式为 ,
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA2时, NaCl溶液的PH= (假设电解过程中溶液的体积不变) 。
(4)可逆反应2EC2(气)+C2(气) 2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2 和2molEC2,使V (A ) = V (
B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t
( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2 的转化率:a( A ) _a( B )。
2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2 和2molEC2,使V (A ) = V (
B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t
( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2 的转化率:a( A ) _a( B )。

(5)欲比较C和E两元素的非金属性相对强弱,可采取的措施有 (填“序号”)。
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com