
| A. | N2和NCl3两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | CO2和SiO2的熔沸点和硬度差异很大,是由于它们所含的化学键类型不同 | |
| C. | 某些金属与非金属原子间能形成共价键 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大 |
分析 A.元素化合价的绝对值+该元素原子最外层电子数=8,元素原子满足8电子结构;
B.CO2和SiO2均含极性共价键,分别为分子晶体、原子晶体;
C.氯化铝为共价化合物;
D.分子晶体的相对分子质量越大,分子间作用力越大,熔沸点越大.
解答 解:A.元素化合价的绝对值+该元素原子最外层电子数=8,元素原子满足8电子结构,氮气存在N≡N,且N原子上均有1对孤对电子,则N2和NCl3两种分子中每个原子的最外层都具有8电子稳定结构,故A正确;
B.CO2和SiO2均含极性共价键,分别为分子晶体、原子晶体,则熔沸点和硬度差异很大,化学键相同而晶体类型不同,故B错误;
C.氯化铝为共价化合物,则某些金属与非金属原子间能形成共价键,故C正确;
D.分子晶体的相对分子质量越大,熔沸点越大,则F2、Cl2、Br2、I2的熔、沸点逐渐升高,是因为分子间作用力越来越大,故D正确;
故选B.
点评 本题考查较综合,涉及电子排布、化学键、晶体类型及作用力,为高频考点,把握物质结构与性质为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:实验题
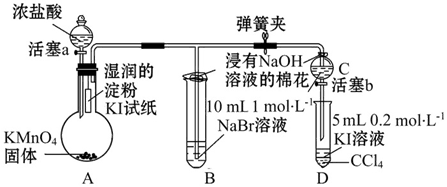
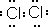 ,在该反应中浓盐酸表现了还原性和酸性.
,在该反应中浓盐酸表现了还原性和酸性.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
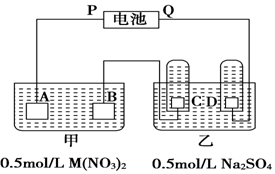
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | 所需试剂 | 离子方程式 |
| FeSO4(CuSO4) | ||
| Na2SO4(NaHCO3) | . |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子云表示电子在核外单位体积的空间出现的机会多少 | |
| B. | 同一原子处于激发态时的能量一定高于基态时的能量 | |
| C. | 各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 | |
| D. | 1个原子轨道里最多只能容纳2个电子,且自旋方向相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
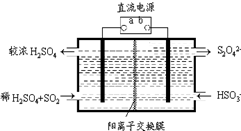 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com