
【题目】初中化学常见物质A-I分别是下列物质中的一种:锌、氢氧化钠、硫酸铜溶液、稀盐酸、碳酸钠溶液、石灰水、生石灰、石灰石和水。他们之间相互的反应(每种物质只能用一次)恰好包含了化合反应(A+B)、分解反应(C)、置换反应(D+E)、中和反应(F+G)、复分解反应(H+I)等反应类型。试回答下列问题:
(1)A+B的反应化学方程式是______________________。
(2)C的化学式为___________;硫酸铜溶液参加___________反应(填反应类型)。
(3)H+I的反应方程式是_________________________________。
【答案】CaO+H2O =Ca(OH)2 CaCO3 置换 Na2CO3+Ca(OH)2=CaCO3![]() +2NaOH
+2NaOH
【解析】
化合反应为两种或两种以上物质反应生成一种化合物的反应;分解反应为一个物质反应生成两种或两种以上物质的反应;复分解反应为由两种化合物互相交换成分,生成另外两种化合物的反应;置换反应为一种单质和一种化合物生成另外一种单质和化合物的反应。
(1)所有物质中能发生化合反应的是氧化钙与水的反应,反应方程式为CaO+H2O =Ca(OH)2。
(2)所有物质中能发生分解反应的是碳酸钙,则C为CaCO3;硫酸铜与锌发生置换反应。
(3)氢氧化钠与稀盐酸发生中和反应,因为每种物质只能用一次,故发生复分解反应的是碳酸钠与氢氧化钙,反应方程式为Na2CO3+Ca(OH)2=CaCO3![]() +2NaOH。
+2NaOH。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)元素周期表中与Z元素同周期原子半径最大的是(写元素名称)__________,其最高价氧化物对应的水化物含有的化学键类型____________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)根据下图实验,可以证明碳的非金属性比X强。饱和小苏打溶液的作用__________。发生的离子方程式是:__________________
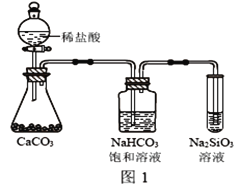
(5)重水(D2O)是重要的核工业原料,下列说法错误的是________。
a.氘(D)原子核内有1个中子
b.1H与D互称同位素
c.H2O与D2O互称同素异形体
d.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是
A. 图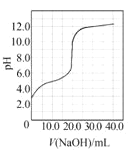 是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
B. 图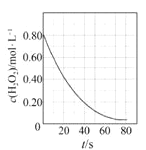 是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图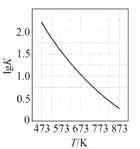 是CO(g)+H2O(g)
是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
D. 图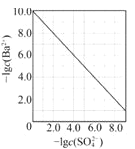 是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
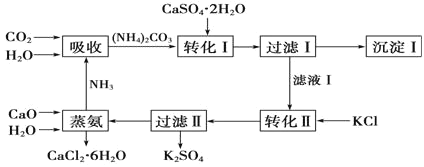
【题目】石膏转化为硫酸钾和CaCl2的工艺流程如图:
![]()
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是___(用化学方程式表示)。
(2)过滤Ⅰ得到的滤液是___,检验滤液中含有CO32-的方法__。
(3)转化Ⅱ中发生反应的化学方程式为___,转化Ⅱ中可获得K2SO4的原因是__。
(4)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是___。
a.熔点较低(29℃熔化) b.能制冷
c.无毒 d.能导电
(5)废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。而电解法产生的强氧化物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性溶液来模拟。阳极的电极反应式___,处理1mol(NH4)2SO4,需要消耗HClO物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如右图所示,其中固体电解质只允许Li+通过。下列说法正确的是
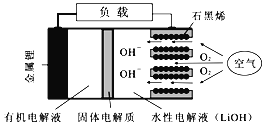
A. 放电时,负极反应式:Li-e-+OH-=LiOH
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1 molL-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
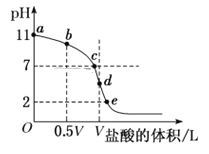
(1)该温度时NH3·H2O的电离常数K=________。
(2)滴定过程中所用盐酸的浓度________molL-1。
(3)比较b、c、d三点时的溶液中,水电离程度最大点为___________。(填字母)
(4)滴定时,由b点到c点的过程中,下列各选项中数值变大的是___(填字母,下同)。
A. c(H+)/c(OH-) B.c(H+)·c(NH3·H2O)/c(NH4+)
C.c(NH4+)·c(OH-)/c(NH3·H2O) D.c(H+)·c(OH-)
(5)根据以上滴定曲线判断下列说法正确的是______(溶液中N元素只存在NH4+和NH3·H2O两种形式)。
A.点b所示溶液中:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(6)d点之后若继续加入盐酸至图像中的e点(不考虑NH4+水解的影响),则e点对应的横坐标为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() mL 1mo/L
mL 1mo/L ![]() 和
和![]() mL 1mo/L
mL 1mo/L ![]() 两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
两种酸溶液分别加水稀释,稀释溶液体积为V,稀释液pH与其体积变化的关系如图所示。下列说法正确的是
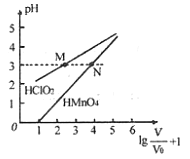
A. ![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B. 在0≤pH≤5时,![]() 溶液满足
溶液满足![]()
C. 分别往M、N两点对应溶液中滴加1 mo/L NaOH溶液至恰好完全反应,消耗NaOH溶液的体积相等
D. 常温下,浓度均为0.1 mo/L的![]() 和
和![]() 溶液,溶液pH:
溶液,溶液pH:![]() >
>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验回答下列问题:

(1)装置A中试管内发生反应的化学方程式是_________________________________。
(2)根据装置B中的现象可以证明SO2具有__________性,反应一段时间后,将装置B中试管加热,可以观察到_______________________。
(3)装置C中试管口的棉花团上发生反应的离子方程式为________________________。
(4)如果将装置B换成装置D,并从直立导管中向氯化钡溶液中通入另一种气体,产生白色沉淀,则这种气体可能是_________________(填一种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com