
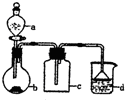
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是| 选项 | A中的物质 | b中的物质 | c中的物质 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO | H2O |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、氨气密度小于空气的密度,收集方法应该为向下排空气法;
B.用MnO2和浓盐酸制取氯气时需要加热;
C.稀硝酸与铜反应生成的是一氧化氮气体,NO和空气中氧气发生反应生成二氧化氮,d中用水无法吸收含一氧化氮的尾气;
D.浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫密度大于空气,氢氧化钠溶液与二氧化硫反应容易发生倒吸.
解答 解:A、氨气的密度比空气密度小,应该采用向下排空气法收集,装置c中的导管应改为短进长出,故A错误;
B.用MnO2和浓盐酸制取氯气时需要加热,氯气的密度比空气大,能使用向上排空气法,氯气用氢氧化钠溶液吸收,故B错误;
C.铜与稀硝酸反应生成产物为一氧化氮,一氧化氮易与空气中氧气反应生成二氧化氮,不能用排空气法收集,氢氧化钠不能吸收一氧化氮气体,故C错误;
D.浓硫酸可以与亚硫酸反应,生成二氧化硫,SO2气体的密度比空气大,能使用向上排空气法,SO2气体能与氢氧化钠迅速反应,所以吸收装置中要防倒吸,图示收集装置和完全吸收装置都合理,故D正确;
故选D.
点评 本题考查化学实验基本原理(气体的制备)、实验装置、仪器的使用,题目难度中等,注意掌握常见气体的制取原理、收集方法及尾气吸收方法,该考点是高考的热点,本题对相关的知识考查的要求较高,本题有利于培养学生对实验的分析能力.


科目:高中化学 来源: 题型:选择题
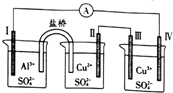
| A. | 电子流向:电极Ⅳ→(A)→电极I | |
| B. | 电极Ⅲ的电极反应:2H2O一4e一=4H++O2↑ | |
| C. | 电极Ⅱ的质量减少,电极Ⅲ的质量增加 | |
| D. | 三个烧杯中的SO42-浓度都始终保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1CuCl2溶液含有3.01×1023个Cu2+ | |
| B. | 28g聚乙烯分子含有的碳原子数为 NA | |
| C. | 0.2mol PCl5分子中,键数目为NA | |
| D. | 标准状况下,3.36L H2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+→Ag+→H+ | B. | Ag+→Ba2+→H+ | C. | H+→Ba2+→Ag+ | D. | H+→Ag+→Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入KSCN溶液,出现血红色,一定不含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com