
【题目】根据题意填空
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为 .
(2)汽车等的安全气囊强烈碰撞时爆炸,发生的反应如后: 10NaN3+2KNO3=K2O+5Na2O+16N2↑下列判断正确的是
A.每生成8molN2转移15mol电子
B.NaN3中氮元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1:15
(3)某化学兴趣小组希望能较长时间观察到白色絮状 Fe(OH)2的生成,用FeSO4(用铁粉与稀硫酸反应制得)和过量NaOH溶液反应制Fe(OH)2的装置示意图如图所示.回答下列问题:
(i)A装置的名称是;在生成Fe(OH)2的装置中,发生的主要反应的离子方程式有
(ii)实验时首先打开活塞3,关闭活塞2,其目的是 .
(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为 .
(iv)若在C中加入的是NH4HCO3时,反应时有气体产生,则最主要的离子方程式将是 .
【答案】
(1)2BrO3﹣+10I﹣+12H+=5I2+Br2+6H2O
(2)D
(3)分液漏斗;H++OH﹣=H2O;Fe2++2 OH﹣=Fe(OH)2↓;排出装置中的空气,防止+2价铁被氧化;4 Fe(OH)2+O2+2 H2O=4 Fe(OH)3;Fe 2++2HCO3﹣=FeCO3↓+CO2↑+H2O
【解析】解:(1)在Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O物质中,KBrO2中溴处于高价态,将碘离子氧化成碘单质,反应的离子方程式为:2BrO3﹣+10I﹣+12H+=5I2+Br2+6H2O,所以答案是:2BrO3﹣+10I﹣+12H+=5I2+Br2+6H2O;(2)A.由反应可知,2molKNO3反应转移电子为2mol×(5﹣0)=10mol,即每生成16 mol N2转移10 mol电子,所以每生成8molN2转移5mol电子,故A错误;
B.NaN3中N元素化合价升高,失去电子被氧化,故B错误;
C.只有N元素的化合价变化,则N2既是氧化产物又是还原产物,故C错误;
D.该反应中10molNaN3是还原剂,生成氧化产物N2的物质的量是15mol;2molKNO3是氧化剂,生成还原产物N2的物质的量是1mol,还原产物与氧化产物质量之比为1:15,故D正确;故选D;(3)(i)A装置的名称是分液漏斗;在生成Fe(OH)2的装置中,发生的主要反应氢氧化钠首先中和过量的酸,然后与亚铁离子发生复分解反应生成氢氧化亚铁,所以反应的离子方程式为:H++OH﹣=H2O;Fe2++2 OH﹣=Fe(OH)2↓,所以答案是:H++OH﹣=H2O;Fe2++2 OH﹣=Fe(OH)2↓;(ii)实验时首先打开活塞3,关闭活塞2,是为了排出装置中的空气,防止+2价铁被氧化,所以答案是:排出装置中的空气,防止+2价铁被氧化;(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为4 Fe(OH)2+O2+2 H2O=4 Fe(OH)3 , 所以答案是:4 Fe(OH)2+O2+2 H2O=4 Fe(OH)3
;(iv)若在C中加入的是NH4HCO3时,是碳酸氢根离子与亚铁离子发生双水解,生成二氧化碳气体,离子反应方程式为:Fe 2++2HCO3﹣=FeCO3↓+CO2↑+H2O,所以答案是:Fe 2++2HCO3﹣=FeCO3↓+CO2↑+H2O.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为 .
(2)汽车等的安全气囊强烈碰撞时爆炸,发生的反应如后: 10NaN3+2KNO3=K2O+5Na2O+16N2↑下列判断正确的是
A.每生成8molN2转移15mol电子
B.NaN3中氮元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1:15
(3)某化学兴趣小组希望能较长时间观察到白色絮状 Fe(OH)2的生成,用FeSO4(用铁粉与稀硫酸反应制得)和过量NaOH溶液反应制Fe(OH)2的装置示意图如图所示.回答下列问题: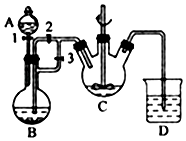
(i)A装置的名称是;在生成Fe(OH)2的装置中,发生的主要反应的离子方程式有
(ii)实验时首先打开活塞3,关闭活塞2,其目的是 .
(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为 .
(iv)若在C中加入的是NH4HCO3时,反应时有气体产生,则最主要的离子方程式将是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸中,KMnO4和H2O2能发生氧化还原反应.
氧化反应:H2O2﹣2e﹣═2H++O2↑
还原反应:MnO4﹣+5e﹣+8H+═Mn2++4H2O
(1)写出该氧化还原反应的化学方程式: .
(2)反应中氧化剂是;被氧化元素是;若有0.5mol H2O2参加此反应,电子转移个数为 .
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为;这时若有0.5mol H2O2发生分解,电子转移个数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室用如下装置制备氯气.请回答: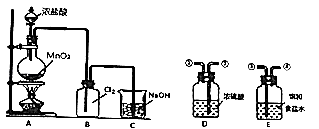
(1)写出A装置中制取氧气的化学方程式: M .
(2)若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是(填写数字编号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,不考虑混合后溶液体积的变化,下列说法错误的是( )
A.0.1mol?L﹣1CH3COOH溶液加水稀释后,溶液中 ![]() 的值增大
的值增大
B.pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1%
C.amol?L﹣1H2C2O4溶液与2amol?L﹣1的NaOH溶液等体积混合后,c(C2O42﹣)>c(HC2O4﹣)>c(H2C2O4)>c(OH﹣)
D.0.1mol?L﹣1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于营养物质的说法正确的是( )
A.油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物
B.1mol蔗糖的水解产物是1mol葡萄糖和1mol果糖
C.淀粉溶液和稀硫酸共热后发生水解反应,冷却后加少量银氨溶液,水浴加热后会出现光亮的银镜
D.鸡蛋白溶液中滴加饱和的硫酸铵溶液,出现白色沉淀,该过程叫做蛋白质的变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应的通式可表示为: 单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质乙为植物光合作用的产物,则该反应的化学方程式为 .
(2)若单质甲和化合物B均具有磁性,则该反应的化学方程式为 .
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 .
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 .
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常常用作耐高温材料,则该反应的化学方程式 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.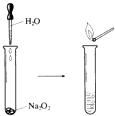
(1)Na2O2中O元素的化合价为 .
(2)如图所示实验,滴入几滴水,现象是 , 反应的化学方程式为 . 实验结束后,向试管所得溶液中滴加酚酞溶液,现象是 .
(3)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧.原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为 . 若标准状况下反应生成了5.6L O2 , 则转移电子的物质的量为mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com