
下列反应的离子方程式表示不正确的是
A.漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O = HClO+HCO
B.FeBr2溶液中通入少量Cl2:2Fe2++Cl2 =2Fe3++2Cl-
C.AgNO3溶液中加入过量稀氨水:Ag++2NH3·H2O = [Ag(NH3)2]++2H2O
D.SO2使氯水褪色:SO2+Cl2+2H2O =SO42-+2Cl-+4H+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:选择题
化学与社会生活密切相关,下列说法正确的是
A.体积分数为95%的酒精通常作为医用酒精
B.石油的分馏、煤的气化、海水的提镁都包含化学变化
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.利用高纯度硅制造的太阳能电池板可将光能直接转化为电能
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl-
D.pH=12的溶液:K+、Na+、CH3COO-、Br-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:填空题
(16分)Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。
已知:①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③Y的基态原子的核外成对的电子数是未成对的电子数的3倍;
④Z基态原子有六个未成对电子。
用对应的元素符号或化学式回答下列问题:
(1)R、X、Y的第一电离能由大到小的顺序为 。
(2)Q元素在元素周期表中属于 区,与Y元素同族的第四周期元素的价电子排布式为 。
(3)RY2的电子式为 ,Z3+的原子结构示意图为____________。
(4)RQ2Y2的结构式为 ,m g该物质完全燃烧后通过足量Na2O2固体吸收,Na2O2固体增重的质量为 g。
(5)由Y、Z两种元素组成的Z2Y72-离子在酸性条件下可与乙醇反应,生成乙酸、Z3+等物质。该反应的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:实验题
“摩尔盐”[ (NH4)2Fe(SO4)2·6H2O ] 是分析化学中的重要试剂。查阅文献得知:“摩尔盐”隔绝空气加热至500℃时可完全分解,但产物复杂。某学习小组欲探究其分解产物。
Ⅰ.【提出猜想】摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O b.FeO、NH3、SO3、H2O
c.FeO、SO2、NH3、H2O d.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想 不成立(填序号)。
Ⅱ.【实验探究】为检验分解产物,甲同学设计了如下实验装置。
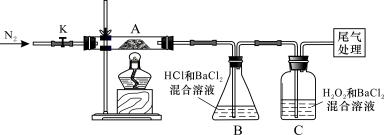
请回答下列问题:
(1)B装置的容器名称是 。
(2)取一定量“摩尔盐”置于加热管A中,加热至分解完后打开K,再通入N2,目的是 。
(3)观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_________________________。
(4)待A中剩余固体冷却至室温后,取少量置于试管中,加入稀硫酸溶解,再滴几滴KSCN溶液,可以观察到的现象是 。
(5)乙同学设计实验验证A中残留物不含FeO,操作方法及实验现象是:取少量A中残留物放入试管中, 。
Ⅲ.【实验反思】
乙同学认为:装置B中产生白色沉淀不能证明分解产物中一定含SO3,原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列物质分类正确的是
A.NO2、Cl2O7都是酸性氧化物 B.水银、水玻璃都是混合物
C.HD、HCHO都是极性分子 D.干冰、可燃冰都是分子晶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:简答题
(本题共12分)碘及其化合物可广泛用于医药和工业生产等。回答下列问题:
1.实验室用海带提取I2时操作步骤依次为:灼烧、溶解、过滤、_______、_______及蒸馏。
2.灼烧海带时除需要三脚架、酒精灯、玻璃棒外,还需要的实验仪器是______________。
3.“过滤”后溶液中含一定量硫酸盐和碳酸盐。现要检验溶液中的I-,需选择的试剂组合及其先后顺序是_____________。(选填编号)
a.AgNO3溶液 b.Ba(NO3)2溶液 c.BaCl2溶液 d.CaCl2溶液
4.在海带灰滤液中加入适量氯水后一定存在I2,可能存在IO3—。
请补充完整检验含I2溶液中是否含有IO3—的实验方案(可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液):
①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②_____________________________________________________________________。
5.分解水可用SO2/I2循环法。该法共涉及三步化学反应。
___________________;2H2SO4  2SO2↑+ O2↑+ 2H2O;____________________。
2SO2↑+ O2↑+ 2H2O;____________________。
与传统的分解水的方法相比,本法的优点是____________;缺点是_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三下学期第三次质检考试理综化学试卷(解析版) 题型:实验题
(15分)已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:
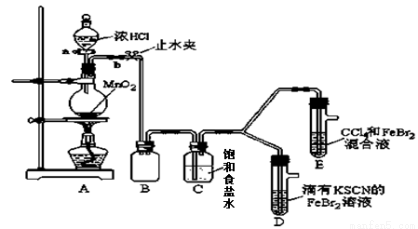
(1)①装置A中发生反应的离子方程式是 。
②整套实验装置存在一处明显的不足,请指出 。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 。 (填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。一段时间后 。(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2 >Br2 >Fe3+ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因 。
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加 溶液,若溶液颜色 。则上述解释是合理的。
小组同学另查得资料如下:
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀原因 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com