
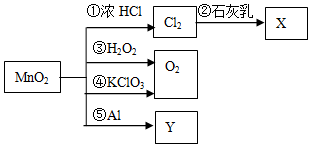
| A. | 反应①中氧化剂与还原剂的物质的量之比为1:4 | |
| B. | 利用反应②可制漂白粉,反应⑤可制金属Mn | |
| C. | 生成等质量的O2,反应③和④转移的电子数相等 | |
| D. | 在反应①③④⑤中,MnO2均作氧化剂 |
分析 A.①中Mn元素的化合价有+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0;
B.反应②氯气与氢氧化钙反应生成氯化钙和次氯酸钙;可用铝热反应冶炼锰;
C.③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0;
D.③④MnO2作催化剂.
解答 解:A.反应①4HCl(浓)+MnO2 $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中Mn元素的化合价由+4价降低为+2价,HCl中Cl元素的化合价由-1价升高为0,由电子守恒可知,氧化剂与还原剂的物质的量之比为1:2,故A错误;
B.反应②氯气与氢氧化钙反应生成氯化钙和次氯酸钙制漂白粉,用铝热反应冶炼锰,所以反应⑤可制金属Mn,故B正确;
C.③中O元素的化合价由-1价升高为0,④中O元素的化合价有-2价升高为0,则相同条件下生成等量的O2,反应③和④转移的电子数之比为1:2,故C错误;
D.反应③④MnO2作催化剂,没有作氧化剂,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意元素的化合价判断及电子守恒应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K+、Na+、SO42-、SCN- | |
| B. | 在强碱性溶液中:K+、Na+、CO3-、AlO2- | |
| C. | 在盐酸溶液中:K+、Fe2+、SO32-、NO3- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 验证淀粉已水解 | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 |
| C | 比较Mg和Al的金属活动性强弱 | 分别用镁、铝为电极,氢氧化钠为电解质的原电池装置中反应现象 |
| D | 除去苯中混有的苯酚 | 向混合液中加入过量浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
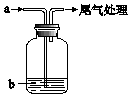 将气体a通入溶液b中,始终无明显变化的是( )
将气体a通入溶液b中,始终无明显变化的是( )| 气体a | 溶液b | |
| A | Cl2 | NaBr |
| B | CO2 | CaCl2 |
| C | SO2 | Ba(NO3)2 |
| D | NO2 | FeSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 向反应瓶中加入6.5g锌粉,然后加入50mL 1.0mol•L-1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
| 操作 | 现象 |
| 将5mL 1.0mol•L-1的FeCl3溶液与0.65g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将5 mL 0.2 mol•L-1(或pH=0.7)的盐酸与0.65g锌粉混合 | 溶液中立即产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究Fe与Cl2反应可能生成FeCl2 | |
| B. | 探究Na与H2O反应可能有O2生成 | |
| C. | 探究Na2O2与SO2反应可能有Na2SO4生成 | |
| D. | 探究Mg与HNO3溶液反应产生的气体中可能含有H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液腐蚀铜印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 硫酸铝溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 浓NaOH溶液处理少量二氧化硫:SO2+OH-═HSO3- | |
| D. | 盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com