
分析 (1)常见的原子晶体有:一些非金属单质,如金刚石、硼、硅、锗等;一些非金属化合物,如二氧化硅、碳化硅、氮化硼等;同种非金属之间形成非极性共价键;
(2)分子晶体中粒子间的作用力为分子间作用力,稀有气体为单原子分子;
(3)原子间以共用电子对结合形成的化学键属于共价键,阴阳离子间以静电作用形成的化学键为离子键,配位键是一种特殊的共价键;
(4)阴阳离子间以静电作用形成的化合物为离子化合物,同种非金属之间形成非极性共价键;
(5)离子晶体熔化克服离子键,原子晶体熔化克服共价键,分子晶体熔化或升华克服分子间作用力;一般熔点规律:原子晶体>离子晶体>分子晶体,分子晶体的相对分子质量越大熔点越高.
解答 解:(1)常见的原子晶体有:一些非金属单质,如金刚石、硼、硅、锗等;一些非金属化合物,如二氧化硅、碳化硅、氮化硼等;同种非金属之间形成非极性共价键;所以含非极性键的原子晶体是:金刚石;
故答案为:B;
(2)稀有气体为单原子分子,是分子晶体,则可由原子直接构成的分子晶体是氦,故答案为:C;
(3)原子间以共用电子对结合形成的化学键属于共价键,阴阳离子间以静电作用形成的化学键为离子键,配位键是一种特殊的共价键,氯化铵中含有离子键、共价键和配位键,
故答案为:F;
(4)阴阳离子间以静电作用形成的化合物为离子化合物,同种非金属之间形成非极性共价键,故含有非极性键的离子化合物是:D,
故答案为:D;
(5)氯化钠为离子晶体,熔化克服离子键;二氧化硅为原子晶体,融化时克服的是共价键,干冰是分子晶体,气化粒子间克服的作用力为范德华力,一般熔点规律:原子晶体>离子晶体>分子晶体,分子晶体的相对分子质量越大熔点越高,则熔点:B>D>A>C;
故答案为:离子键;共价键;范德华力;B>D>A>C.
点评 本题考查晶体类型的判断、晶体中的作用力、化学键等,难度不大,注意知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于M | |
| B. | Y的能量一定高于N | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 因该反应为放热反应,所以一定不必加热就可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
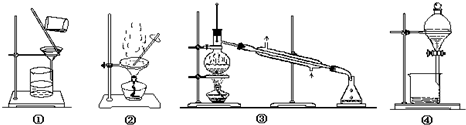
| A. | 用工业酒精制无水乙醇选择装置③ | B. | 提纯含砂石的粗苯甲酸选择装置①② | ||
| C. | 从溴水中提纯溴选择装置④ | D. | 苯中混有少量溴苯选择装置③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素与非金属元素能形成共价化合物 | |
| B. | 只有在原子中,质子数与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 氧和臭氧互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 ? NaOH H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s时容器内c(Y)=0.76 mol/L | |
| B. | 830℃达平衡时,X的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应R(g)+Q(g)?X(g)+Y(g)的平衡常数K=0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 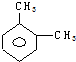 | B. | 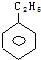 | C. | 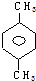 | D. | 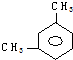 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com