
| A、过量的铁屑与稀硝酸混合 |
| B、将铁屑投入到稀盐酸溶液中 |
| C、用氯化铁溶液制作铜的印刷电路板 |
| D、把铁屑放入氯化铁溶液中 |


科目:高中化学 来源: 题型:
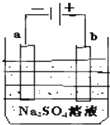 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实验现象中正确的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实验现象中正确的是( )| A、逸出气体的体积,a电极的小于b电极的 |
| B、有一电极逸出有刺激性气味的气体 |
| C、a电极附近呈红色,b电极附近呈蓝色 |
| D、a电极附近呈蓝色,b电极附近呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol H2O 含有NA个水分子 |
| B、1 g氢气含有NA个H2 |
| C、1 mol Zn与过量稀盐酸反应生成 NA个氢气分子 |
| D、32 g CH4 中含有 5 NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1% | B、2% | C、3% | D、4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②④⑤ |
| C、①③⑥ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com