
| A. | 常温常压下,16gO2中含有的氧分子数为NA | |
| B. | 1molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2LH2O中含有的氢原子数为NA | |
| D. | 1mol/LBaCl2溶液中含有的钡离子数为NA |
分析 A、根据氧气分子个数N=$\frac{m}{M}{N}_{A}$来计算;
B、OH-为10电子微粒;
C、标况下,水为液态;
D、溶液体积不明确.
解答 解:A、16g氧气中的氧气分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{16g}{32g/mol}$×NA=0.5NA个,故A错误;
B、OH-为10电子微粒,故1molOH-中含10mol电子,故B正确;
C、标况下,水为液态,故不能根据气体摩尔体积来计算水的物质的量,故C错误;
D、溶液体积不明确,故溶液中钡离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 图I表示盐酸滴加到0.1mol/L某碱溶液中得到的滴定曲线,由图I可知二者恰好中和时,所得溶液的pH=7 | |
| B. | 图II表示一定条件下进行的反应2SO2+O2?2SO3△H<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 | |
| C. | 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20ml Ba(OH)2溶液时,沉淀是Al(OH)3与BaSO4的混合物 | |
| D. | 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO4、H2SO4、CH3COOH、H2CO3酸性依次减弱 | |
| B. | Cl-、Na+、Mg2+、F-的半径依次减小 | |
| C. | Na、Mg、Al失电子能力随最外层电子的增加而增强 | |
| D. | HI、HBr、HCl、HF的沸点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
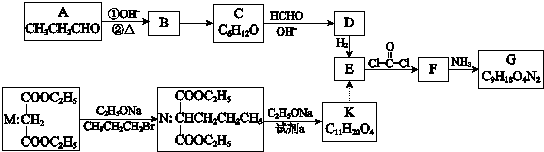
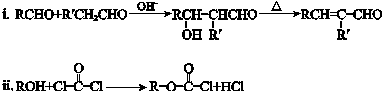
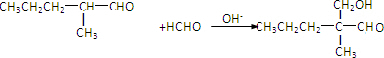 .
.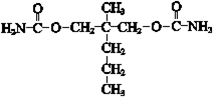 .
.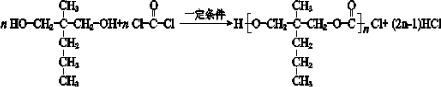 .
.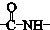 ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是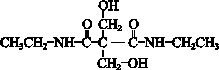 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝需经过特别处理能具有抗腐蚀能力 | |
| B. | “地沟油”经过加工处理可用来制肥皂 | |
| C. | 嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
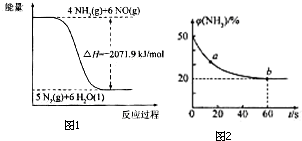 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与V2O5发生铝热反应 | B. | 镁粉投入到FeCl3溶液中 | ||
| C. | 碳粉与CuO混合物在试管中加热 | D. | 水蒸气通入足量Na2O2粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com