
【题目】有一化学平衡mA(g)+nB(g)pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( ) 
A.△H<0;△S<0
B.△H>0;△S>0
C.△H<0;△S>0
D.△H>0;△S<0
【答案】D
【解析】解:由图可知,在一条等压线上,温度越高,A的转化率越大,则升高温度、平衡正向移动,可知正反应为吸热反应,即△H>0;
向横坐标作垂线可知,相同温度下,压强越大,A的转化率越大,则增大压强,平衡正向移动,可知该反应为气体体积减小的反应,m+n>p+q,即△S<0,
故选D.
【考点精析】关于本题考查的化学平衡状态本质及特征,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】下列离子能在pH=12的水溶液中大量共存的一组是
A.SO42-、NO3-、K+、H+B.Na+、Cl-、OH-、Fe3+
C.Cl-、NO3-、K+、Na+D.Na+、Cl-、SO42-、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芒硝化学式为Na2SO410H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
①该电解槽的阳极反应式为 . 此时通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)导出.
③通电开始后阴极附近溶液pH会(填“增大”、“减小”或“不变”).
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池.已知H2的燃烧热为285.8kJmol﹣1则该燃料电池工作产生36g H2O时理论上有kJ的能量转化为电能.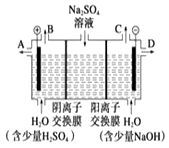
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol H+的质量是1g
B.标准状况下,1 mol水占的体积是22.4 L
C.二氧化硫的摩尔质量是64g
D.1 L 1 mol·Lˉ1盐酸溶液中,有1 mol HCl分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物的结构简式,完成下列填空。
①CH3CH2CH2C(CH3)3
②HCOOCH2CH3
③CH3CHClCH2CH3
④CH3CHClCH===CHCH3

⑨(CH3)2CHCOOH ⑩CH3CHO
对以上有机化合物进行分类,其中:
(1)含有羟基(—OH)的是____________。
(2)含有羟基但不属于醇的是____________。
(3)属于烯烃的是____________。
(4)属于芳香烃的是____________。
(5)属于羧酸的是____________。
(6)属于醛的是____________。
(7)属于卤代烃的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图由短周期元素形成的物质之间的转化关系,其中A、D、L为单质,其他为化合物.其中化合物I、J、K中含有两种相同的元素,G和I的反应⑤是一种重要化工生产中的主要反应之一.B常温下为液态化合物,F是一种直线型的非极性气体分子.
试回答下列有关问题:
(1)以上7个化学反应属于同种元素自身氧化还原反应的是;(用编号①→⑦填写)
(2)在G、J、H中含有相同的元素是(填元素名称);
(3)J的水溶液和F(填“能”或”否”)发生反应,其理由是;
(4)写出电解溶液H的离子反应方程式;
(5)反应⑤的化学方程式是;
(6)写出J的两种常见用途、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项( )

锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
A | 碱 | 酸 | 石蕊 | 乙 |
B | 酸 | 碱 | 酚酞 | 甲 |
C | 碱 | 酸 | 甲基橙 | 甲 |
D | 酸 | 碱 | 酚酞 | 乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g)2C(g)△H<0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol.回答下列问题:
(1)反应达平衡时B在平衡混合气体中的体积分数为;
(2)若反应温度升高,A的转化率;(填“增大”、“减小”或“不变”)
(3)该温度下该反应的平衡常数K=;
(4)平衡后,其他条件不变的情况下,将体积压缩到原来的 ![]() 时,对该反应产生的影响是;
时,对该反应产生的影响是;
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(5)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 .
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.体系的压强不随时间而改变
(6)若维持容器体积和温度不变,某时刻测得A、B、C的浓度分别为1mol/L、3mol/L、2mol/L,则此时该反应的正反应速率逆反应速率.(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为V2O5+xLi ![]() LixV2O5 . 下列说法中正确的是( )
LixV2O5 . 下列说法中正确的是( )
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时为阳极
C.该电池充电时阳极的反应为LixV2O5﹣xe﹣═V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com