
| A、标准状况下,22.4L已烷中共价键数目为19NA |
| B、26g乙炔与苯的混合物中所含量碳原子数为0.2 NA |
| C、在标准状况下,2.24L乙炔中的σ键数为0.3 NA |
| D、1 mol苯加氢气加成最多需要氢分子数为6 NA |
| V |
| 22.4 |
| 26g |
| 13g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片不用特殊方法保存 |
| B、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| C、轮船水线以下的船壳上装一定数量的锌块 |
| D、镀锌的铁比镀锡的铁耐用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、遭遇氯气意外泄漏,有关方面应该组织群众沿逆风方向疏散 |
| B、金属钠着火燃烧时,用水浇灭 |
| C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| D、保存氢氟酸的玻璃瓶要塞紧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、TNT的结构简式为: |
B、苯乙醛的结构简式为: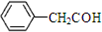 |
C、丙烷分子的球棍模型为: |
| D、乙烯的结构简式为:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④③②① | B、①③④② |
| C、②③④① | D、①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 |
| B、配制FeC13溶液时,将一定量的氧化铁溶解在较浓的盐酸中,再用蒸馏水稀释到所需浓度 |
| C、层析法分离含有少量Cu2+和Fe2+的混合溶液时,亲水性强的Cu2+在滤纸下方 |
| D、湿度计是利用氯化钴晶体中结晶水数目不同而颜色不同来设计的,湿度高时呈蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com