
【题目】下列化学物质在实际生产、生活和科技等方面的应用正确的是( )
A. 我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B. 生产普通玻璃的主要原料有石灰石、石英和纯碱
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 玻璃上的漂亮花纹都依靠浓硫酸的腐蚀作用
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
![]()
判断BaCl2溶液已经过量的方法___________________________________________
第4步中加入Na2CO3溶液的目的是将溶液中的_____(填离子符号)转化为______(填化学式)沉淀而除去。
第6步中加入适量盐酸时发生反应的化学方程式_________________________________________
蒸发结晶时会用到下列仪器中的__________________(填仪器名称)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A. 2︰1 B. 1︰1 C. 1︰2 D. 1︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各原子或离子的电子排布式错误的是( )
A. Al 1s22s22p63s23p1 B. S2- 1s22s22p63s23p4 C. Na+ 1s22s22p6 D. F 1s22s22p5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
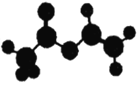
A. 该化合物的名称为乙酸乙酯
B. 该化合物的链状同分异构体中,能与NaHCO3反应放出CO2的只有3种
C. 该化合物既能发生水解反应.又能发生缩聚反应
D. 该化合物与Br2的四氯化碳溶液不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 3.01×1023个CO2分子中含_____________mol氧原子,在标准状况下其体积为____L,0.4 molOH-的中有 ______个电子。
(2)实验中需取0.1mol CuSO4配制溶液,若用CuSO4 5H2O替代,则应称取CuSO4 5H2O的质最为___g。
(3)同温同压下,等质量的N2和CO2所含分子数比为_____,体积比为________。
(4)某气体在标准状况下的密度为1.25g/L,则28g该气体所含有的分子数为_____________。
(5)在标准状况下22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为____g。
(6)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制过程中需量取浓硫酸____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属相关说法正确的是
A. 金属原子失电子越多,元素的金属性越强
B. 可以通过最高价氧化物对应水化物的碱性强弱来判断元素金属性强弱
C. 铁可以从所有强酸溶液中置换出氢气
D. 活泼性强的金属都可以从溶液中置换出活泼性弱的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com