
 法测定某橙汁中维生素C的含量,其化学方程式如下所示.下列说法正确的是
法测定某橙汁中维生素C的含量,其化学方程式如下所示.下列说法正确的是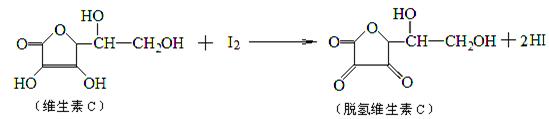
| A.上述反应为还原反应 | B.滴定时应剧烈振荡锥形瓶 |
| C.滴定时可用淀粉溶液作指示剂 | D.滴定时可用酚酞作指示剂 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
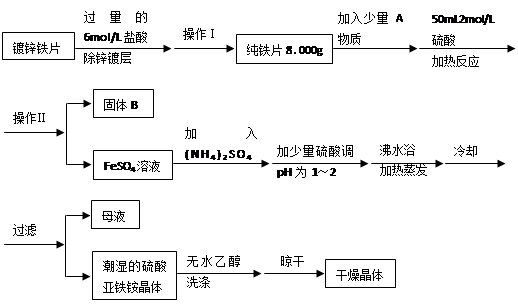
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
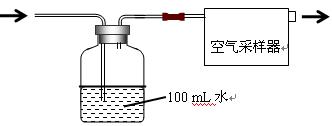
| 环境温度/℃ | 5 | 10 | 15 | 20 | 25 | 30 | 35 |
| 显色时间/min | 45 | 30 | 15 | 13 | 10 | 7 | 5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
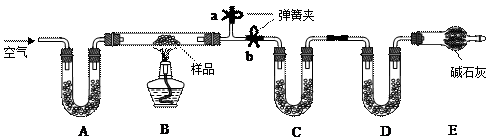
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
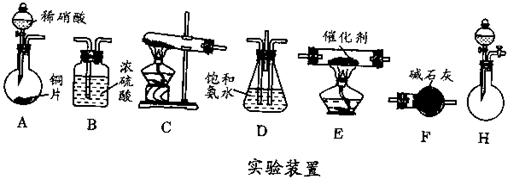
 _____________。
_____________。
| 试剂组合序号 | 固体试剂/g | NH3体积/mL |
| a | 12.0g Ca(OH)2(过量) 10.8g NH4Cl | 2688 |
| b | 12.0g Ca (OH)2(过量) 10.8g(NH4)2SO4 (OH)2(过量) 10.8g(NH4)2SO4 | 2728 |
| c | 12.0g NaOH(过量) 10.8g NH4Cl | 3136 |
| d | 12.0g NaOH(过量) 10.8g (NH4)2SO4 | 3118 |
| e | 12.0g CaO(过量) 10.8g NH4Cl | 3506 |
| f | 12.0g CaO(过量) 10.8g (NH4)2SO4 | 3584 |
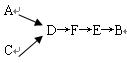
 ____________。
____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
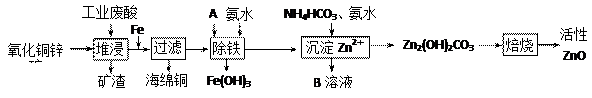
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com