
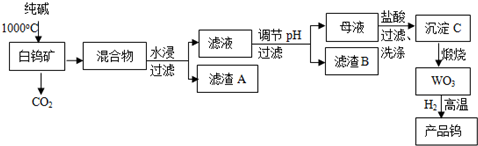
���� ���ٿ����Ҫ�ɷ���CaWO4�����ж������衢�����������ʣ����ٿ���̼������1000���¶��·�Ӧ������������̼���ƻᷴӦ���ɹ����ƣ�����������Ӧ���õ��Ļ������ˮ��ȡ�����˺����Һ����ϵ�в����õ�WO3��˵��̼������CaWO4��Ӧ����Na2WO4��������AΪ�������ȣ���Һ�к���Na2SiO3��Na2WO4���ٵ���pH��5��8֮�䣬ʹ�����ת��ΪH2SiO3�������˳�ȥ��ĸҺ�к���Na2WO4���ټ�������õ�����CΪH2WO4�����ղ����������ٺ�ˮ���ٻ�ԭ�õ��٣�
��1������ÿ��������Ԫ�������ж�Ԫ���������ڣ�
��2��CaWO4�봿�Ӧ����Na2WO4��CaO�������̼��
��3������BΪ���ᣬ������ҺpHʹ�����ת��ΪH2SiO3�������˳�ȥ��Ӧ�����
��4��ĸҺ��Na2WO4������õ�H2WO4�������Ȼ��ƣ��������C�ı���ḽ��NaCl������������Һ�������һ��ϴ��Һ���Ƿ����������жϣ�
��5��̼�����������û����٣���̼Ϊ���壬���Է��룬��̼�ͽ������ڸ����»ᷴӦ����̼���٣�
��6������Ksp��CaWO4��=c��Ca2+����c��WO4-������c��Ca2+�����ٸ���Ksp[Ca��OH��2]=c��Ca2+����c2��OH-������c��OH-��������������Һ��$\frac{c��W{O}_{4}^{2-}��}{c��O{H}^{-}��}$��
��� �⣺���ٿ����Ҫ�ɷ���CaWO4�����ж������衢�����������ʣ����ٿ���̼������1000���¶��·�Ӧ������������̼���ƻᷴӦ���ɹ����ƣ�����������Ӧ���õ��Ļ������ˮ��ȡ�����˺����Һ����ϵ�в����õ�WO3��˵��̼������CaWO4��Ӧ����Na2WO4��������AΪ�������ȣ���Һ�к���Na2SiO3��Na2WO4���ٵ���pH��5��8֮�䣬ʹ�����ת��ΪH2SiO3�������˳�ȥ��ĸҺ�к���Na2WO4���ټ�������õ�����CΪH2WO4�����ղ����������ٺ�ˮ���ٻ�ԭ�õ��٣�
��1����74-2-8-8-18-32=6�����ٴ��ڵ������ڣ�
�ʴ�Ϊ������
��2��CaWO4�봿�Ӧ����Na2WO4��CaO�������̼����Ӧ����ʽΪ��CaWO4+Na2CO3$\frac{\underline{\;1000��\;}}{\;}$Na2WO4+CaO+CO2����
�ʴ�Ϊ��CaWO4+Na2CO3$\frac{\underline{\;1000��\;}}{\;}$Na2WO4+CaO+CO2����
��3������B����Ҫ�ɷ�ΪH2SiO3��������ҺpHʹ�����ת��ΪH2SiO3�������˳�ȥ��Ӧ�������ᣬ
�ʴ�Ϊ��H2SiO3��C��
��4��ĸҺ��Na2WO4������õ�H2WO4�������Ȼ��ƣ���Ӧ���ӷ���ʽΪ��WO42-+2H+=H2WO4�����������C�Ƿ�ϴ�Ӹɾ��IJ����ǣ�ȡ���һ�ε�ϴ��Һ�������Թ��У�����1��2��ϡ���ᣬ�ٵμ�1��2��AgNO3��Һ�����ް�ɫ����
���ɣ���˵�������Ѿ�ϴ�Ӹɾ��������ְ�ɫ�������������δϴ����
�ʴ�Ϊ��WO42-+2H+=H2WO4����ȡ���һ�ε�ϴ��Һ�������Թ��У�����1��2��ϡ���ᣬ�ٵμ�1��2��AgNO3��Һ�����ް�ɫ�������ɣ���˵�������Ѿ�ϴ�Ӹɾ��������ְ�ɫ�������������δϴ����
��5�������̼����ԭ���������ڽ����е�̼���׳�ȥ������̼���ڸ����ºͽ����ٷ�Ӧ�γ�̼���٣�
������ô��Ľ����٣�����������ԭ���ɱ�������������⣬
�ʴ�Ϊ��̼�����������û����٣���̼Ϊ���壬���Է��룬��̼�ͽ������ڸ����»ᷴӦ����̼���٣�
��6������Һ��WO42-ǡ�ó�����ȫ��������Ũ�ȵ���10-5mol/L������Ksp��CaWO4��=c��Ca2+����c��WO4-��=1��10-10������Һ��c��Ca2+��=1��10-5mol/L���ٸ���Ksp[Ca��OH��2]=c��Ca2+����c2��OH-��=4��10-7����֪c��OH-��=0.2mol/L������Һ��$\frac{c��W{O}_{4}^{2-}��}{c��O{H}^{-}��}$=$\frac{1{0}^{-5}}{0.2}$=5��10-5��
�ʴ�Ϊ��5��10-5��
���� �������ڻ�ѧ����������Ŀ���漰���ʵķ����ᴿ����ԭ���ķ������ۡ�ʵ������������ܶȻ��йؼ���ȣ��ؼ��ǶԹ������̵����⣬�Ƕ�ѧ���ۺ������Ŀ��飬�Ѷ��еȣ�


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ����Һ��Fe3+���ʵ���Ϊ0.8mol | |
| B�� | ��Ӧ�����13.44L H2����״���� | |
| C�� | ��Ӧ����Һ��Fe2+��Fe3+���ʵ���֮��Ϊ0.9mol | |
| D�� | ����������Fe3+��H+���ʷ�Ӧ����û������������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25��ʱ��1LpH=13��Ba��OH��2��Һ�к��е�OH-��Ϊ0.2NA | |
| B�� | 18gD2O�к��е�������Ϊ9NA | |
| C�� | Fe������Cl2��ȼ������0.5mol���ת�Ƶĵ�����ΪNA | |
| D�� | ��״���£�11.2LCCl4���еķ�����Ϊ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3OH��ȼ����Ϊ1452kJ•mol-1 | |
| B�� | 2H2��g��+O2��g���T2H2O��g����H��-571.6kJ•mol-1 | |
| C�� | 2CH3OH��l��+O2��g���T2CO2��g��+4H2��g����H=-880.4kJ•mol-1 | |
| D�� | CH3COOH��aq��+NaOH��aq���TH2O��l��+CH3COONa��aq����H=-57.3kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �������� | ʵ������ |
| �����﴿����CO2����ͨ�������Ƶ����ž������ĸ��ﲣ�����У����� | ��ȼ�գ�����Ϊ��ɫ |
| ��Ӧ����ȴ | �ܱڸ��к�ɫ�����Ͱ�ɫ���� |
| ʵ�鲽�� | ʵ������ |
| ��������ɫ�������Թ��У���������ˮ������Ʒȫ������ˮ�������мӹ�����CaC12��Һ���ְ�ɫ���� | ���ְ�ɫ���� |
| �ھ���Ƭ�̣�ȡ�ϲ���Һ���Թ��У��μ���ɫ��̪��Һ | ���������� |
| ʵ������з�����Ӧ�Ļ�ѧ����ʽ | ʵ����������������ĸ��ʾ�� | ʵ�������Լ������ֱ�ʾ�� | ʵ����ֱ�Ӳⶨ���й���������������˵���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� �ܽ�� ��ѧʽ | 0�� | 10�� | 20�� | 30�� | 40�� |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
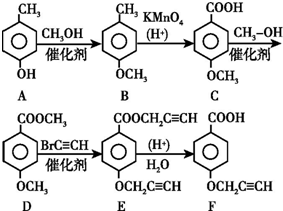
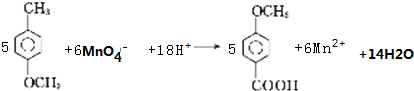 ��
��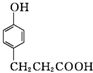 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com