
| A、酸性:H2SiO3<H3PO4<H2SO4 | B、碱性:NaOH>KOH>CsOH | C、半径:C1->C1>Na | D、沸点:H2O>H2S>H2Se |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、酸性:HI>HBr>HCl;碱性:NaOH>KOH>RbOH | B、沸点: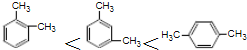 ;熔点:Na<K<Rb ;熔点:Na<K<Rb | C、可燃性:H2O<NH3<CH4;还原性:HCl<H2S<PH3 | D、还原性:Na>Mg>Al;氧化性:P>S>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.酸性:HClO4>HBrO4>HIO4;碱性:NaOH>KOH>RbOH
B.沸点:Cl2<Br2<I2;熔点:Na<K<Rb
C.可燃性:H2O<NH3<CH4;还原性:HCl<H2S<PH3
D.还原性:Na>Mg>Al;氧化性:P>S>Cl2
查看答案和解析>>
科目:高中化学 来源:2014届四川省绵阳市高二12月月考化学试卷(解析版) 题型:选择题
根据元素性质递变规律,下列判断不正确的是
A.酸性:H2SiO3< H3PO4< H2SO4 B.电负性:I >Cl> Br >F
C.第一电离能:N > O > C D.沸点:H2O> H2Te >H2Se >H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com