
| A. | AgCl沉淀生成和溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 其他条件不变时,加水可使Ksp(AgCl)增大 | |
| D. | 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
分析 溶解平衡为的动态平衡,AgCl饱和溶液中存在Ag+和Cl-,达到平衡时,正逆反应速率相等,改变离子浓度,可使平衡发生移动,注意溶度积只与温度有关,以此解答.
解答 解:A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不断进行,是动态平衡,速率相等但是不为零,故A正确;
B.AgCl难溶于水,溶解度很小,但是不为零,所以溶液中含有少量的Ag+和Cl-,故B错误;
C.Ksp只与温度有关,温度不变Ksp不变,不随浓度的改变而改变,故C错误;
D.加入NaCl固体,氯离子浓度增大,沉淀溶解平衡逆向进行,会析出AgCl固体,AgCl的溶解度减小,故D错误;
故选A.
点评 本题主要考查了沉淀溶解平衡及其影响因素,题目难度不大,明确溶解平衡的实质及其影响因素为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu丝--电解质;KOH--电解质 | |
| B. | NaCl--电解质;葡萄糖(C6H12O6)--非电解质 | |
| C. | NaCl溶液--非电解质;酒精--非电解质 | |
| D. | O2--不属于电解质或非电解质;MgCl2--非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=6 mol•(L•min)-1 | B. | v(C)=0.5 mol•(L•s)-1 | ||
| C. | v(B)=0.6 mol•(L•s)-1 | D. | v(A)=0.15 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- | |
| B. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 | |
| C. | 实验的溶液中含有[Ag(NH3)2]+微粒 | |
| D. | 实验证明了该温度下Ag2S比Ag2SO4更难溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀少于AgBr沉淀 | D. | AgCl沉淀多于AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
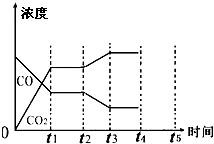 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| -c(NO)/mol•L -1 | 1.00×10 -3 | 4.50×10-4 | 2.50×10 -4 | 1.50×10 -4 | 1.00×10 -4 | 1.00×10 -4 |
| -c(CO)/mol•L-1 | 3.60×10 -3 | 3.05×10 -3 | 2.85×10 -3 | 2.75×10 -3 | 2.70×10 -3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
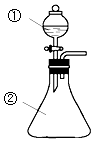 将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )
将①中液体逐滴滴入到②中(如图),实验结果与预测的现象一致的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 氨水 | 氯化铝溶液 | 产生白色沉淀 |
| B | 浓硫酸 | 铜片 | 产生大量气体溶液变蓝 |
| C | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 |
| D | 稀盐酸 | Na2CO3与NaOH的混合液 | 立即产生大量气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com