
【题目】甲、乙为两个容积均为1 L的恒容密闭容器,向甲中充入1 mol CH4和1 mol CO2,乙中充入1 mol CH4和m mol CO2,加入催化剂,只发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是( )
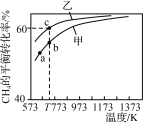
A.该反应的正反应是放热反应
B.a、b、c三点处,容器内气体总压强:p(a)<p(b)<p(c)
C.T K时,该反应的平衡常数小于12.96
D.恒温时向甲的平衡体系中再充入CO2、CH4各0.4 mol,CO、H2各1.2 mol,重新达平衡前,v(正)>v(逆)
【答案】BC
【解析】
A. CH4的平衡转化率随温度的升高而升高,平衡正向移动,该反应的正反应是吸热反应,故A错误;
B. a、b温度升高,平衡正向移动,压强增大,p(a)<p(b);b、c,c的CH4的平衡转化率高,说明充入了更多的CO2,压强p(b)<p(c),a、b、c三点处,容器内气体总压强:p(a)<p(b)<p(c),故B正确;
C. T K时,假设甲的甲烷的转化率为60%,先算出平衡常数,
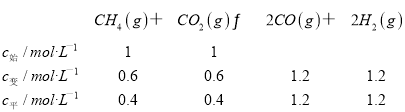
T K时,K=![]() =12.96,平衡时甲的甲烷的转化率小于60%,,该反应的平衡常数小于12.96,故C正确;
=12.96,平衡时甲的甲烷的转化率小于60%,,该反应的平衡常数小于12.96,故C正确;
D. Qc=![]() =12.96>K,恒温时向甲的平衡体系中再充入CO2、CH4各0.4 mol,CO、H2各1.2 mol,重新达平衡前,v(正)<v(逆),故D错误;
=12.96>K,恒温时向甲的平衡体系中再充入CO2、CH4各0.4 mol,CO、H2各1.2 mol,重新达平衡前,v(正)<v(逆),故D错误;
故选BC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于硝酸的说法不正确的是( )
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热炼镁还原渣[Al、Ca(AlO2)2、Al2O3、MgO及少量不能被碱液溶出的尖晶石型铝的化合物等]制取Al(OH)3的工艺流程如下:
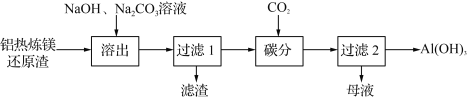
(1) “滤渣”成分包括:水合铝酸钙、尖晶石型铝的化合物、不含铝的化合物______________(写两种物质的化学式)。
(2) “溶出”时,在适当条件下,铝及其大部分含铝化合物以NaAlO2溶出。
①金属Al与NaOH溶液反应的化学方程式为________________________________。
②其他条件相同时,Na2CO3、NaOH溶液的浓度对铝的溶出率的影响如图所示:
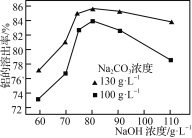
NaOH溶液浓度一定时,130 g·L-1的Na2CO3溶液对铝的溶出率比100 g·L-1的大,这是因为______________(从平衡移动角度分析);Na2CO3溶液浓度一定时,当NaOH溶液浓度大于80 g·L-1,铝的溶出率随NaOH溶液浓度增大而减小,可能原因是______________。
(3) “碳分”时,溶液与过量CO2反应的离子方程式为________________________。
(4) “过滤2”的母液经再生处理可返回“溶出”工序循环使用,再生的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用 50mL 0.50 mol·L-1 的盐酸与 50mL 0.50 mol·L-1 的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算反应热。下列 说法中,不正确的是( )
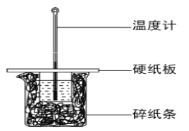
A.实验过程中有一定的热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的主要作用是固定小烧杯
D.若将盐酸体积改为 60 mL,理论上所求反应热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学反应原理的说法正确的是( )
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.反应物的热效应与是否使用催化剂无关
C.已知中和热![]()
![]() ,则1mol浓
,则1mol浓![]() 和1mol
和1mol![]() 的反应热
的反应热![]()
D.向![]() 溶液中通入少量HCl气体,溶液的导电性明显增强
溶液中通入少量HCl气体,溶液的导电性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是
A.用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+=H2SiO3(胶体![]()
B.FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.少量NaHSO4溶液与Ba(OH)2溶液反应:H++OH-+SO42-+Ba2+=H2O+BaSO4↓
D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油的成分之一,它的结构简式为: ![]() ,请回答:
,请回答:
(1)胡椒酚所含官能团的名称为____。
(2)它能发生的化学反应是___(填序号)。
①氧化反应 ② 取代反应 ③ 加成反应 ④消去反应 ⑤ 加聚反应
(3)1 mol 胡椒酚与氢气发生加成反应,理论上最多消耗____ mol H2。
(4)1 mol 胡椒酚与浓溴水发生反应,理论上最多消耗_____mol Br2。
(5)若要制备胡椒酚钠,可以选择的试剂是____(填序号)。
① Na ② NaOH ③ NaHCO3 ④ Na2CO3
(6)写出所有符合下列条件的胡椒酚的同分异构体的结构简式:____。
① 能发生银镜反应;② 苯环上有两个取代基,且苯环上的一氯代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 a~g 在表中的位置如右表,请回答下列问题:

(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________;b、c两元素非金属性较强的是(写元素符号)_________,写出能证明这一结论的一个化学方程式_____________。
(2)下列有关说法正确的是(___)
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+) _______(填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法中
①结构片段为…… ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚
②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应:![]()
⑤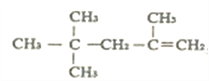 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有 个。
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com