
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填写序号)。
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c(H+)/c(ClO-)减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为____。
(3)常温下,已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________________________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因__________________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)WI2(g)。为模拟上述反应,准确称取0.508 g碘、0.736 g金属钨置于50.0 mL的密闭容器中,加热使其反应。
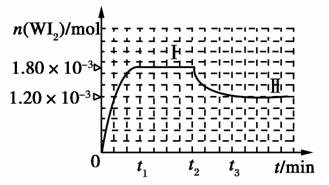
如图是WI2(g)的物质的量随时间变化的关系图像,其中曲线I(0~t2时间段)的反应温度为T1,曲线Ⅱ(从t2开始)的反应温度为T2,且T2>T1。则:
①该反应的ΔH________0(填“>”、“=”或“<”)。
②从反应开始到t1时间内的平均反应速率v(I2)=________。
③下列说法中不正确的是________(填序号)。
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=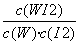
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25 ℃时,向5 mL含有KCl和KI浓度均为0.1 mol·L-1的混合液中,滴加6 mL 0.1 mol·L-1的AgNO3溶液,先生成的沉淀是________,溶液中离子浓度由大到小的顺序是________[不考虑H+和OH-。25 ℃时Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17]。
解析:本题主要考查化学反应速率与化学平衡、电解质溶液等相关知识,意在考查考生运用化学反应原理分析和解决问题的能力。(1)氨水中存在HClOH++ClO-和H2OH++OH-两种电离平衡,A项正确;向氯水中通入SO2,当Cl2与SO2物质的量相等时发生反应:Cl2+SO2+2H2O===H2SO4+2HCl,其漂白性减弱,B项错误;当氯水饱和时,通入氯气,c(H+)/c(ClO-)不变,当氯水不饱和时,通入氯气,溶液酸性增强,抑制HClO的电离,c(H+)/c(ClO-)增大,C项错误;加水稀释氯水,溶液中的OH-浓度增大,D项错误;加水稀释氯水,溶液酸性减弱,对水的电离的抑制作用减弱,故水的电离平衡向正反应方向移动,E项正确;向氯水中加入少量固体NaOH,当溶液呈中性时,根据电荷守恒可推出:c(Na+)=c(Cl-)+c(ClO-),F项正确。(2)工业上用电解饱和食盐水的方法制备氯气,反应的离子方程式为2Cl-+2H2O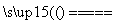 2OH-+Cl2↑+H2↑。(3)由于次氯酸的电离平衡常数在碳酸的两级电离平衡常数之间,因此84消毒液露置在空气中与二氧化碳反应时只能生成碳酸氢钠,其反应的化学方程式为NaClO+CO2+H2O===HClO+NaHCO3,生成的HClO不稳定,见光易分解:2HClO
2OH-+Cl2↑+H2↑。(3)由于次氯酸的电离平衡常数在碳酸的两级电离平衡常数之间,因此84消毒液露置在空气中与二氧化碳反应时只能生成碳酸氢钠,其反应的化学方程式为NaClO+CO2+H2O===HClO+NaHCO3,生成的HClO不稳定,见光易分解:2HClO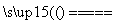 2HCl+O2↑。ClO-与Cl-在酸性条件下发生氧化还原反应生成Cl2,Cl2有毒,其反应的离子方程式为ClO-+Cl-+2H+===Cl2↑+H2O。(4)①根据图示,温度越高,WI2(g)的物质的量反而越小,即平衡逆向进行,而升高温度,化学平衡向吸热方向进行,所以逆向吸热,故正向放热,即ΔH小于0。②结合图像可知,从反应开始到t1,时间内,生成WI2(g)的物质的量为1.8×10-3 mol,所以消耗I2(g)的物质的量为1.8×10-3 mol,v(I2)=
2HCl+O2↑。ClO-与Cl-在酸性条件下发生氧化还原反应生成Cl2,Cl2有毒,其反应的离子方程式为ClO-+Cl-+2H+===Cl2↑+H2O。(4)①根据图示,温度越高,WI2(g)的物质的量反而越小,即平衡逆向进行,而升高温度,化学平衡向吸热方向进行,所以逆向吸热,故正向放热,即ΔH小于0。②结合图像可知,从反应开始到t1,时间内,生成WI2(g)的物质的量为1.8×10-3 mol,所以消耗I2(g)的物质的量为1.8×10-3 mol,v(I2)=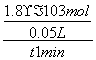 =
=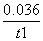 mol·L-1·min-1。③由题目信息可知利用该反应原理可以提纯钨,A项正确;固体单质W的浓度不能列入平衡常数表达式中,B项错误;灯丝附近温度越高,促进化学平衡向吸热方向(即逆向)进行,灯丝附近区域WI2越易变为W而重新沉积到灯丝上,C项正确。(5)AgI的溶度积小于AgCl的溶度积,故先生成的沉淀是AgI,溶液混合反应之后,溶液中含有0.001 mol K+、0.000 6 mol NO
mol·L-1·min-1。③由题目信息可知利用该反应原理可以提纯钨,A项正确;固体单质W的浓度不能列入平衡常数表达式中,B项错误;灯丝附近温度越高,促进化学平衡向吸热方向(即逆向)进行,灯丝附近区域WI2越易变为W而重新沉积到灯丝上,C项正确。(5)AgI的溶度积小于AgCl的溶度积,故先生成的沉淀是AgI,溶液混合反应之后,溶液中含有0.001 mol K+、0.000 6 mol NO 和0.000 4 mol Cl-,同时得到0.000 5 moI AgI和0.000 1 mol AgCl,故溶液中离子浓度由大到小的顺序为:c(K+)>c(NO
和0.000 4 mol Cl-,同时得到0.000 5 moI AgI和0.000 1 mol AgCl,故溶液中离子浓度由大到小的顺序为:c(K+)>c(NO )>c(Cl-)>c(Ag+)>c(I-)。
)>c(Cl-)>c(Ag+)>c(I-)。
答案:(1)AEF
(2)2Cl-+2H2O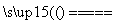 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
(3)NaClO+CO2+H2O===HClO+NaHCO3、2HClO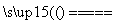 2HCl+O2↑ ClO-+Cl-+2H+===Cl2↑+H2O
2HCl+O2↑ ClO-+Cl-+2H+===Cl2↑+H2O
(4)①< ②0.036/t1 mol·L-1·min-1 ③B
(5)AgI c(K+)>c(NO )>c(Cl-)>c(Ag+)>c(I-)
)>c(Cl-)>c(Ag+)>c(I-)


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
从海水提取溴的过程中,吸收塔内溴蒸气和吸收剂SO2发生的化学反应为:
Br2 + SO2 + 2H2O == 2HBr + H2SO4,下列说法正确的是 ( )
A.Br2在反应中表现还原性 B.SO2在反应中被还原
C.Br2在反应中失去电子 D.1mol氧化剂在反应中得到2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
向某无色溶液中分别进行下列操作,所得现象和结论正确的是( )
A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+
B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl-
C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO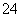
D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH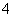
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )

A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中n(FeBr2)=3 mol
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质用途的说法中,正确的是( )
A.二氧化硅可用作半导体材料
B.硝酸常用作金属铜加工前的酸洗
C.碳酸钠可用于治疗胃酸过多
D.三氧化二铁常用于生产红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
将含O2和CH4的混合气体充入装有23.4gNa2O2的密闭容器中,点火花点燃,反应结束后,容器温度为150℃、压强为0 Pa。将残留物溶于水,无气体逸出。下列叙述正确的是( )
A.原混合气体中O2和CH4的体积比为2∶1;
B.原混合气体中O2和CH4的体积比为1∶2;
C.残留固体中有Na2CO3和NaOH;
D.残留固体中只有Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.淀粉和蛋白质均可作为生产葡萄糖的原料
B.实验室可用酸性高锰酸钾溶液鉴别甲苯和己烯
C.石油裂化和油脂皂化都是高分子生成小分子的过程
D.装饰材料中的甲醛和芳香烃会造成居室污染
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
A.47 B.57
C.61 D.175
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.弱碱性溶液中可能大量存在Na+、K +、Cl‾、HCO3‾
+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com