
| 催化剂 |

| △c |
| t |
| 0.1mol/L |
| 2s |
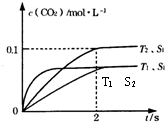 ,
, ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 |
| B、硅的来源丰富,易于开采,且可再生 |
| C、硅燃料放出的热量大,且燃料产物对环境污染较低,容易有效控制 |
| D、寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量,是硅能源大规模开发利用的一项关键技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列有关该粒子的说法中不正确的是( )
,下列有关该粒子的说法中不正确的是( )| A、x值有6种以上的可能 |
| B、M粒子的符号可能是O2-、Ne、Al3+等 |
| C、M粒子表示的阴离子中还原性最弱的是N3- |
| D、取含有M粒子的溶液进行焰色反应,若为黄色,则M的符号是Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和碳酸钠溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| B、pH=2的醋酸中:c(H+)=0.02mol?L-1 |
| C、0.1mol?L-1氯化铵溶液中:c(H+)>c(OH-)>c(Cl-)>c(NH4+) |
| D、pH=12的NaOH溶液与等体积0.01mol?L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(NH4+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com