
【题目】38.4g铜跟适量的浓硝酸反应,铜全部作用后,共收集到22.4L(标准状况)气体.则反应消耗HN03的物质的量可能是( )
A.1 mol
B.1.6 mol
C.2.2 mol
D.2.4 mol
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有_________。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。

①为了保证实验成功,装置A应具有的现象是___________,搅拌的目的是___________。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是_______________________________。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4·7H2O)。实验模拟制备皓矾工业流程如下:

①氧化中加入硫酸铁发生反应的离子方程式是____________________。
②加入Zn粉的目的是_________________________________。
③固体A主要成分是__________________。
④操作b得到纯净皓矾晶体,必要的操作是蒸发浓缩、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是重要的催化剂,可用某钒矿石(含有 V2O3、Fe、Al2O3等)来制备,工艺流程如下:
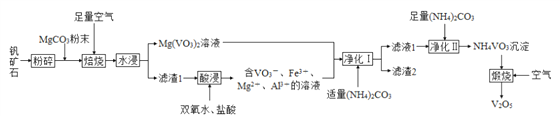
请回答下列问题:
(1) 钒矿石“粉碎”的目的为__________。
(2)“滤渣1” 中除 Al2O3、 Fe(VO3)2、 Fe(VO3)3外,还含有__________(填化学式)。
(3)“酸浸”时,若用硝酸代替双氧水和盐酸,弊端为__________。
(4)“滤渣 2” 的主要成分为 MgCO3、Fe(OH)3和 Al(OH)3,其中生成 Al(OH)3的离子方程式为__________。
(5) 若“净化Ⅰ” 时直接加入足量的(NH4)2CO3,可能导致的后果为__________。
(6)“煅烧”时,还生成参与大气循环的气体,该反应的化学方程式为__________。
(7)产品中 V2O5纯度的测定: 称取产品 a g, 先用硫酸溶解,得到(VO2)2SO4溶液;再加入 V1 mL c1 mol·L-1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+=VO2++Fe3++H2O); 最后用 c2 mol·L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗 KMnO4标准溶液的平均体积为 V2 mL。假设杂质不参与反应,则产品中 V2O5的质量分数为__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有1molKAl(SO4)2的溶液中加入Ba(OH)2溶液,使SO42-恰好完全沉淀,此时Al(OH)3的物质的量为( )
A.1molB.1.33molC.1.67molD.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的应用中,利用了该物质氧化性的是( )
A.液氨——作制冷剂
B.甘油——作护肤保湿剂
C.FeCl3——用于铜制印刷版的制作
D.食醋——除去水壶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷和乙烯的说法中正确的是
A. 乙烯在空气中燃烧,出现明亮的蓝紫色火焰
B. 乙烯使酸性KMnO4溶液褪色是因为乙烯被酸性KMnO4溶液氧化
C. 甲烷与氯气光照条件下反应生成的三氯甲烷常温下是气态
D. 乙烯分子中含一个碳碳双键和两个碳氢单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________;该温度下 平衡常数K=___________。
(2)工业合成氨的反应方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH 下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图D 是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图D 是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。

下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PAB
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KAB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为![]() mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的![]() 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( ) 
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.y和z的最高价氧化物对应水化物均为强酸
D.若z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com