
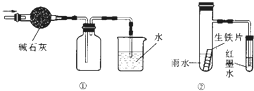
| A、提取溴水中的溴,可用加入乙醇萃取的方法 |
| B、用蒸发溶剂的方法将10%的氯化铁溶液变为20%的氯化铁溶液 |
| C、用图 ①的装置可以收集一瓶干燥的氨气 |
| D、用图 ②的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 |


科目:高中化学 来源: 题型:
A、5NH4NO3
| ||||
| B、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | ||||
| C、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | ||||
| D、高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中:K+、Cu2+、Na+、C1-、SO42- | ||
| B、pH=ll的溶液中:HCO3-、Na+、NH3.H2O、NO3- | ||
C、常温下,
| ||
| D、在含有大量Fe3+的溶液中:A13+、Na+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 三氯化铁是合成草酸铁的重要原料.
三氯化铁是合成草酸铁的重要原料.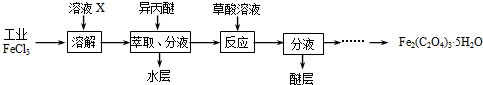
查看答案和解析>>
科目:高中化学 来源: 题型:
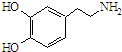 所示.试回答下列问题:
所示.试回答下列问题: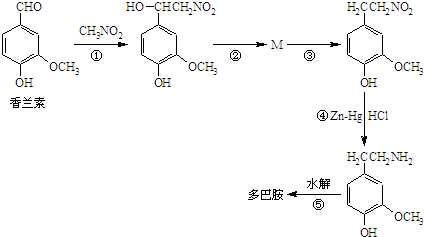
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
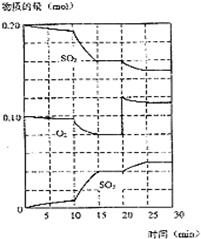 已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:
已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃,能燃烧的为矿物油 |
| B、加入水中,浮在水面上的为植物油 |
| C、加入足量的NaOH溶液共煮,不再分层的为植物油 |
| D、尝一尝,能食用的为植物油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com