
【题目】铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。
(1)还原沉淀法是处理含Cr2O72-和CrO42-工业废水的一种常用方法,其工艺流程为:
![]()
其中第Ⅰ步存在平衡:2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=0,该溶液显__________色。
②根据 2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
Cr2O72-(橙色)+H2O设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。Na2Cr2O7中铬元素的化合价为_________,图中右侧电极连接电源的_________极,其电极反应式为_________________。
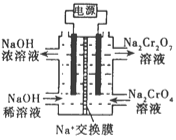
③第Ⅱ步反应的离子方程式:_________________________。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。完成该反应的化学方程式:
![]()
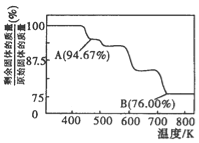
(3)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。B点时剩余固体的成分是____________(填化学式)。
【答案】(1)①橙;②+6,正极;4OH--4e-=O2↑+2H2O;③6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
(2)4,3,6,2,3,9H2O;(3)Cr2O3.
【解析】
试题分析:(1)①若平衡体系的pH=0,溶液酸性较强,平衡2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O正向移动,溶液呈橙色;
Cr2O72-(橙色)+H2O正向移动,溶液呈橙色;
②由化合价代数和为0可知Na2Cr2O7中铬元素的化合价为+6价,根据2Cr2O42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
Cr2O72-(橙色)+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
③亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬,铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O;
(3)设固体质量为100g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为24g,两者的个数比为![]() =2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3。
=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别方法不可行的是( )
A. 用水鉴别乙醇、甲苯和溴苯
B. 用燃烧法鉴别乙醇、苯和四氯化碳
C. 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D. 用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是

A.由题给图示可求出25℃时醋酸的电离平衡常 数Ka=10-4.75
B.W点所表示的溶液中:c(Na+)+c(H+) =c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0L溶液中通入0.05mol HCl气体(溶液体积变化可忽略):c(H+) = c(CH3COOH) + c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是 ( )
A.SO2具有还原性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.氢氧化铝具有弱碱性,可用作净水剂
D.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)利用H2 和CO在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
CH3OH(g)(放热反应)。对此反应进行如下研究:在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。
①10min后达到平衡时CO的浓度为 ;
②10min内用H2表示的平均反应速率为 ;
③若要加快CH3OH的生成速率,可采取的措施有 (填一种合理的措施)
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①已知:4.4gCO2与H2完全转化为CH2=CH2和水(气态)共放出6.39kJ的热量,写出该反应的热化学方程式 。
②不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。

下列有关说法不正确的是 (填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
③若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为 。(保留两位有效数字)
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。

请回答:
(1)工业上制C用A不用H的原因 。
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)写出E物质的电子式 。
(5)J与H反应的离子方程式为 。
(6)写出G与熟石灰反应制取漂白粉的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应生成的铁常因其中含有铝而形成合金。一定质量的铁铝合金溶于足量的NaOH溶液中,完全反应后产生6.72 L(标准状况下)气体;用同样质量的铁铝合金完全溶于足量的盐酸中,在标准状况下产生11.2 L气体。则该合金中铝、铁的物质的量之比为
A.1︰1 B.2︰5 C.3︰2 D.3︰5
查看答案和解析>>
科目:高中化学 来源: 题型:
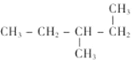
【题目】下列共有十二种化学符号:
①O2 ②![]() C ③238U ④
C ③238U ④![]() Na ⑤O3 ⑥
Na ⑤O3 ⑥![]() N ⑦
N ⑦![]() Mg ⑧
Mg ⑧![]()
⑨235U ⑩![]()
![]()
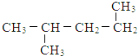
![]()
其中:
(1)表示核素的符号共有___种。
(2)互为同位素的是___(填序号,以下相同)。
(3)质量数相等,但不能互称同位素的是__。
(4)中子数相等,但质子数不相等的是___。
(5)互为同素异形体的是___。
(6)互为同分异构体的是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com