
| A. | 为提高反应速率,可换用98%的浓硫酸 | |
| B. | 在反应过程中,水的电离程度逐渐增大 | |
| C. | 在反应体系中加入硫酸钠溶液,反应速率不变 | |
| D. | 在反应体系中加入少量醋酸钠固体,反应速率变慢,生成氢气的量减少 |
分析 A.浓硫酸和Zn反应生成二氧化硫而不是氢气;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.加入硫酸钠溶液,氢离子浓度降低;
D.加入醋酸钠固体时,稀硫酸和醋酸反应生成醋酸,溶液中氢离子浓度减小,反应速率降低,但最终电离出氢离子物质的量不变.
解答 解:A.浓硫酸和Zn反应生成二氧化硫而不是氢气,所以不能用浓硫酸通过改变浓度来制取氢气,故A错误;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,随着反应进行,溶液中氢离子浓度减小、硫酸锌浓度增大,所以在反应过程中,水的电离程度逐渐增大,故B正确;
C.加入硫酸钠溶液,氢离子浓度降低,所以反应速率减小,故C错误;
D.加入醋酸钠固体时,稀硫酸和醋酸反应生成醋酸,溶液中氢离子浓度减小,反应速率降低,但最终电离出氢离子物质的量不变,则生成氢气总量不变,故D错误;
故选B.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度对反应速率影响原理是解本题关键,注意浓硫酸性质的特殊性,易错选项是A,注意D中生成氢气总量与电解质强弱无关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入1mol N2和3mol H2,充分反应生成NH3分子数为2NA | |
| B. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| C. | 30g SiO2中含有的Si-O键数目为2NA | |
| D. | 标准状况下,4.48 L N2所含的共用电子对数0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
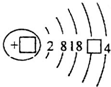 ,请补充完整:
,请补充完整: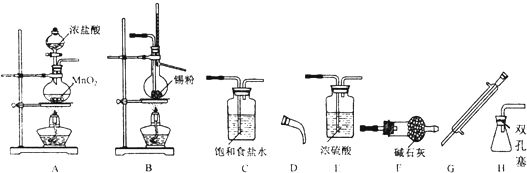
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、NO3-、MnO4- | B. | Na+、NO3?、SO42?、I? | ||
| C. | K +、Fe3+、Cl-、Br- | D. | Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某气体通入品红溶液中,能使其褪色,则该气体为二氧化硫 | |
| B. | 向Fe(NO3)2溶液中滴加稀盐酸溶液变成黄色 | |
| C. | 某无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀生成,则原溶液中含有SO42- | |
| D. | 钠在空气中燃料产物为白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋-C2H5OH | B. | 明矾-KAl(SO4)2 | C. | 苏打-NaHCO3 | D. | 生石灰-CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在电离平衡、水解平衡和沉淀溶解平衡 | |
| B. | c(Na+)=c(Cl-)>c(HCO3-)>c(CO32-)=c(Ca2+) | |
| C. | c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-) | |
| D. | 反应的离子方程式:2HCO3-+Ca2+═CaCO3↓+H2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com