
| A、10% | B、大于10% |
| C、小于10% | D、5% |


科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol?L-1) | 0.100 | 0.0508 | 0.0254 | 0.00635 |
查看答案和解析>>
科目:高中化学 来源: 题型:
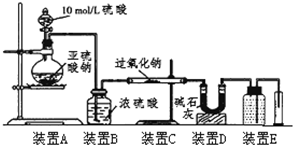 某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.
某校化学兴趣小组在学习了过氧化钠性质后,进一步研究其与SO2反应情况,查阅相关资料知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有同学认为:CO2、SO2虽然都是酸性氧化物,但SO2具有较强的还原性,CO2无还原性,反应原理应该不相同,并设计如下实验进行探究.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | |
| 未被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30% | B、35% |
| C、65% | D、70% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
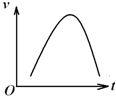 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl-的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然气是以甲烷为主要成分的高效清洁燃料 |
| B、煤的干馏可得到煤焦油,通过煤焦油的分馏可获得各种芳香烃 |
| C、石油中含有烷烃和环烷烃,因此由石油不可能获得芳香烃 |
| D、通过石油的催化裂化及裂解可以得到轻质油和气态烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存 |
| B、钢铁发生吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O |
| C、常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存 |
| D、NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com