
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | H2的燃烧热为285.8kJ/mol:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8kJ/mol | |
| D. | 碳在高温下还原二氧化硅 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
分析 A.碳酸氢根离子水解生成碳酸和氢氧根离子;
B.醋酸铵为强电解质,完全电离;
C.燃烧热生成产物为稳定的氧化物;
D.碳与二氧化硅反应生成硅和一氧化碳.
解答 解:A.NaHCO3的水解,离子方程式:HCO3-+H2O?OH-+H2CO3,故A错误;
B.醋酸铵的电离:CH3COONH4=CH3COO-+NH4+,故B错误;
C.氢气燃烧生成液态水最稳定,故C错误;
D.碳在高温下还原二氧化硅 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故D正确;
故选:D.
点评 本题考查了离子方程式、热化学方程式、化学方程式的书写,明确盐类水解实质、离子方程式书写方法是解题关键,注意燃烧热的概念.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
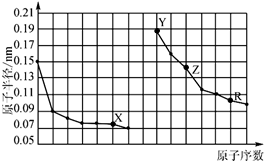
| A. | X、R的最高化合价相同 | |
| B. | 电解熔融的X与Z构成的化合物可以得到单质Z | |
| C. | X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1 | |
| D. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
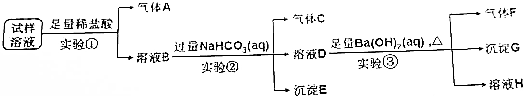
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
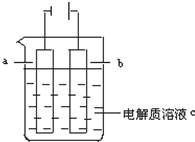 如图所示:
如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
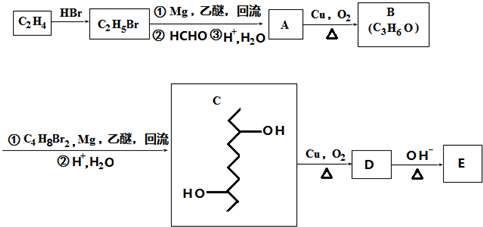
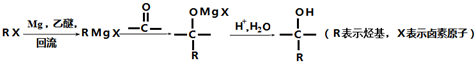

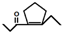 ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式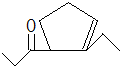 、
、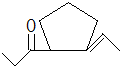 .
.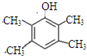 或
或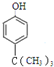
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com