
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
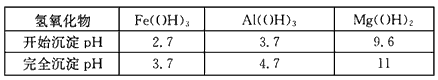
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
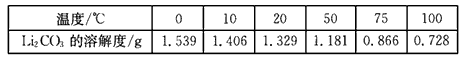
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
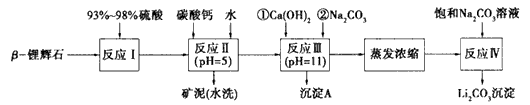
以![]() —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
回答下列问题:
(1)反应II中加碳酸钙的作用是 。
(2)写出反应III中生成沉淀A的离子方程式 、 。
(3)写出反应IV的化学方程式 。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)实验室中常用于蒸发浓缩的硅酸盐质的仪器有______________。
A、蒸发皿 B、玻璃棒 C、铁架台(带铁圈) D、酒精灯 E、圆底烧瓶
查看答案和解析>>
科目:高中化学 来源:2010年广东省汕头市潮阳一中理综化学考前押题卷 题型:实验题
 —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
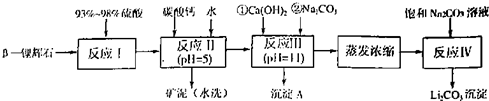
以 —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下: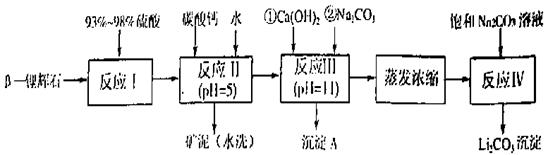
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
| A.蒸发皿 | B.玻璃棒 | C.铁架台(带铁圈) | D.酒精灯 E、圆底烧瓶 |
查看答案和解析>>
科目:高中化学 来源:2010年广东省汕头市理综化学考前押题卷 题型:实验题
 —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
以 —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下:
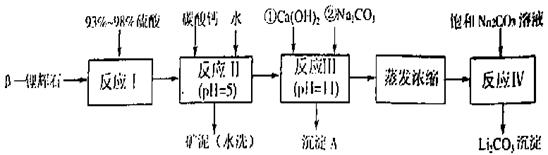
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
2.7 |
3.7 |
9.6 |
|
完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度的溶解度如下表:
|
温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
|
Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
回答下列问题:
(1)反应II中加碳酸钙的作用是 。
(2)写出反应III中生成沉淀A的离子方程式 、 。
(3)写出反应IV的化学方程式 。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)实验室中常用于蒸发浓缩的硅酸盐质的仪器有______________。
A、蒸发皿 B、玻璃棒 C、铁架台(带铁圈) D、酒精灯 E、圆底烧瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com