
| c(标准)×V(标准) |
| V(待测) |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
 |  | 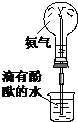 |  |
| ① | ② | ③ | ④ |
| A、实验①中溶液变黄色 |
| B、实验②试管中混合溶液变红色 |
| C、实验③中烧瓶内溶液变红色 |
| D、实验④中出现砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不是电解质的物质就是非电解质 |
| B、将纯水加热至较高温度,Kw变大 |
| C、BaSO4不溶于水,其水溶液的导电能力很弱,所以为弱电解质 |
| D、电解质在任何状态下都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、垃圾处理常用的方法是卫生填埋、堆肥和焚烧 |
| B、将垃圾分类并回收是处理的发展方向 |
| C、填埋垃圾不需要治理,只需深埋即可 |
| D、垃圾是污染物,不会产生二次污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
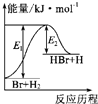
| A、该反应的△H=+(E1-E2)kJ?mol-1 |
| B、加入催化剂,该化学反应的反应热变大 |
| C、反应物的总能量高于生成物的总能量 |
| D、该反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2>I2>S |
| B、O2>S>I2 |
| C、I2>O2>S |
| D、S>I2>O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制高铁酸钾用 KClO做还原剂 |
| B、Fe(OH)3是还原剂 |
| C、高铁酸钾中铁的化合价为+7 |
| D、制备高铁酸钾时1 molFe(OH)3得到3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数.
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中NaHCO3的质量分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com